随着夏天的到来,全国一致性评价的热度继续上升,小编科室的溶出度试验进行得热火朝天、如火如荼。大家是不是也和小编一样正在溶出仪旁边挥汗如雨?
溶出度试验的重要性已经毋庸置疑,既能剖析口服固体制剂的不同处方工艺特点,又能体现参比制剂的内在优良品质。

溶出试验的工作量也是任重道远,恰逢小编实验室有个项目正在配合药检所的复核,需要进行1批参比制剂和3批自制样品的溶出曲线比较,掐指一算,20条曲线!
大家知道仿制药的研发过程中有下面两点一定会做:
首先,需要测定参比制剂的多条溶出曲线。
其次,是仿制药研发的进程:小试 →中试 →放大批(每个步骤样品的多条曲线应与参比制剂一致,直至放大生产到一定规模的连续三批)。
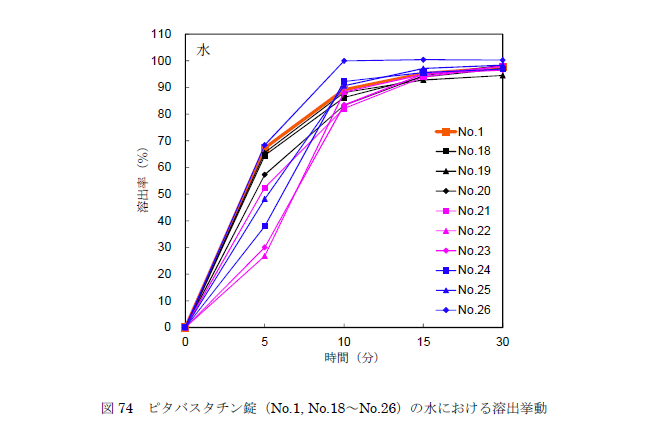
那么,溶出曲线对比过程中有哪些原则需要遵循?
小编今天简单说一下几个主要遵循的原则,更加详细的内容请参阅《普通口服固体制剂溶出曲线测定与比较指导原则》
关注公众号:铭研医药,后台回复“溶出曲线”下载《指导原则》
溶出试验方法的建立
溶出试验方法应能客观反映制剂特点、具有适当的灵敏度和区分力。可参考有关药典标准或文献。
但是,在我们所能获取的各国药典质量标准或是很多原研企业公开的标准中,很多品种的溶出度试验均具有一定的“隐晦性”,只因当产品成型以后,有区分力的溶出方法就不需要了。
所以药典标准只能作为参考。
要设计有区分力的溶出方法,需要秉承“质量源于设计”的理念。我们要掌握药物的溶解性、渗透性、pKa常数等理化性质,并对参比制剂进行深度剖析和解读,考察溶出装置、介质、搅拌速率和取样间隔期等试验条件,确定适宜的试验方法。
这一部分小编未来会找个实例给大家分享。
溶出方法学的验证的内容请参考文章:【药物分析】含量99.6%的药研干货—手把手教你溶出方法学验证
参比制剂批号的遴选
原则上需购买不同时间点的不同批号(至少3批),分别在各pH值溶出介质中测定,观测溶出曲线波动情况。
在曲线比对时,要求自制样品的含量与参比制剂的差值应在5%以内,每个品种各取12个单位,但在小试阶段或是预实验时可以测定6个单位,甚至可以更少。
在进行仿制药研发时,考虑到原研产品批间差异与耐受性,建议最好从市场流通渠道获得有效期内不同时间段的3~5批样品,分别测定后,取结果均值用于比较。
如果主成分是在溶解状态下进行溶出度试验的(如一些散剂、颗粒剂),则适当选择某一批号即可。
溶出介质的选择
溶出介质的研究应根据药物的性质,充分考虑药物在体内的环境,选择多种溶出介质进行,必要时可考虑加入适量的表面活性剂、酶等添加物。
在确定药物主成分稳定性满足测定方法要求的前提想下,推荐选择不少于3种pH值的溶出介质进行曲线考察。
常用介质pH值为1.0、4.5、6.8和水。
根据药物性质也可进行变动。一般情况下,不同介质的pH选择原则如下:
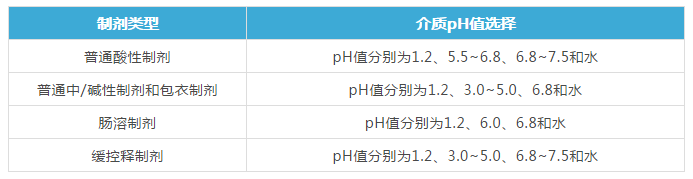
水可作为溶出介质,但使用时应考察其pH值和表面张力等因素对药物及辅料的影响。
部分缓释制剂需研究酒精引起的突释
如盐酸二甲双胍缓释片、阿片类药物的缓释制剂。酒精不应该引起药物的突释,如果有,应与参比制剂一致。
此时需要验证的介质还有:
0.1mol/L盐酸+0%乙醇;
0.1mol/L盐酸+5%乙醇(啤酒);
0.1mol/L盐酸+20%乙醇(混合);
0.1mol/L盐酸+40%乙醇(白酒)。
同样需要12个单位,介质体积为900ml,每隔15分钟取样,至2h结束。
pH依赖性制剂
对于pH依赖性制剂,应对溶解度急剧变化的pH值范围予以细分(±0.5,甚至±0.1),找到45~60min达85%的pH值介质和90~120min达85%的pH值介质,且溶出曲线应无拐点和突释。
推荐使用的各种pH值溶出介质的制备方法,见《普通口服固体制剂溶出曲线测定与比较指导原则》。
这里需要强调一下,pH1.0盐酸介质理论上是量取9ml浓盐酸→1000ml水中(USP中pH1.0盐酸介质理论上是量取8.5ml浓盐酸→1000ml水中),pH1.2盐酸介质理论上是量取7ml浓盐酸→1000ml水中,两种溶液中浓盐酸的体积不同。
并且在首次配制盐酸介质时需要测定pH,记录所用浓盐酸的真实体积,按照理论值量取的介质pH值一般比真实值更高。
测定与结束时间选择
测定时间点
普通制剂和肠溶制剂可为5、10、15、20、30、45、60、90、120分钟,此后每隔1小时进行测定。
缓控释制剂可为15、30、45、60、90、120分钟,3、4、5、6、8、10、12、24小时。
结束时间点
1.连续两点溶出量均达85%以上,且差值在5%以内。一般在酸性溶出介质(pH1.0~3.0)中考察时间不超过2小时。
2.在其他各pH值介质中普通制剂不超过6小时。
3.缓控释制剂一般设定50rpm、并以每天服用次数设定取样时间点,如该制剂每天需服用1次,溶出曲线应测定至24h,并在该时间内曲线应呈缓慢上升状,且无突释和拐点。
溶出条件的优化
在截止时间内,如果药物在所有溶出介质中平均溶出量均达不到85%时,可优化溶出条件,直至出现一种溶出介质达到85%以上。优化的手段包括提高转速,加入适量的表面活性剂、酶等添加物。
常用的表面活性剂常用十二烷基硫酸钠和吐温-80。表面活性剂浓度以0.01%(w/v)为起点,按照1、2、5级别逐步增加,不建议采用3.0%以上浓度。

还有一点需要强调,针对某个释放慢的溶出介质,大家观点有争议:
一部分人认为,此时无需放宽试验参数,最终溶出量未达85%仍可进行自制样品与参比制剂的曲线比较,因已有三条曲线达85%、且其中还含有区分力介质,故该介质无需再深入研究。
还有的同仁觉得,应该加入表面活性剂或提高转速使溶出量达到85%,再进行相似因子比较。
小编认为,具体情况具体分析吧,没有一定的标准,只能Case by Case 。
对于难溶性口服固体制剂,如在50rpm条件下任何一个介质在120min均达不到85%,则建议放宽溶出度试验参数,仍是应尽可能采用低转速和低浓度表面活性剂,仍是以45~120min达到85%的条件确定为准。

提到转速小编想起有次参加培训,有个厂家代表提出这样一个问题:
该厂家作为某一制剂的首仿,BE试验证实两者等效,但是在50rpm条件下,各溶出介质都无法体外相似,而CDE要求补充体外溶出一致的数据,最后一位国内大咖给的意见就是将转速由50rpm提高到65rpm。有类似情况的同仁们可以进行借鉴。
溶出曲线的比对
自美国和日本等国的官方机构认定采用模型非依赖方法之一的“相似因子比较法”之后,现基本上被统一采纳。该法特点是对溶出曲线进行整体评价,通过计算相似因子(f2)比较溶出行为的相似性。
f2因子计算方法
最基本的条件:参比和自制样品必须采用同剂型、同规格的制剂。应确保在完全相同的条件下对受试样品和参比样品的溶出曲线进行测定。
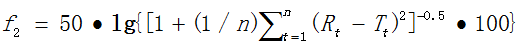
Rt为t时间参比样品平均溶出量;
Tt为t时间受试样品平均溶出量;
n为取样时间点的个数。
f2因子的计算,时间点的选取应尽量遵循溶出量等分原则:
如最终溶出量为90%,四等分即在制剂的溶出曲线上寻找22.5%、45%、67.5%的最相近的溶出时间点;三等分即在制剂的溶出曲线上寻找30%、60%的最相近的溶出时间点。
计算时两制剂所取时间点必须一致;且计算时间点应不少于3个,普通速释制剂选取3~4个、缓控释制剂选取3~5个,不超过7个;溶出率85%(缓控释制剂80%以上)以上的时间点应不多于1个。
建议研究者可依据参比制剂溶出率的具体情况,以溶出量尽可能等分为原则进行选择。
第一个时间点融出结果的RSD不得过20%,自第2个时间点至最后时间点融出结果的RSD不得过10%。如果不符合,应从仪器适用性予以考虑解决,可以增加转速。但对于本身变异性较大的品种,n应增至12~18。
对于自研样品如各时间点RSD仍超出规定,说明制剂处方工艺仍需优化。
判定标准
采用相似因子(f2)法比较溶出曲线相似性时,一般情况下,当两条溶出曲线相似因子(f2)数值在50~100之间时,可认为溶出曲线相似。
当受试样品和参比制剂在15分钟的平均溶出量均不低于85%时,可认为溶出曲线相似。

需要注意的是,在f2大于50中的药物中存在生物不等效的比例是60.6%,而在生物等效的药物中f2小于50的比例是40.9%,也就是“假阳性”和“假阴性”的存在。体外溶出试验只能模拟药物的释放和溶出速率,只有当这两个过程是药物吸收的限速步骤时,IVIVC才可以建立。
所以溶出曲线的相似并不意味着两者一定生物等效,但该法可降低两者出现临床疗效差异的风险。
如何高效测定溶出度样品
就如文章开头所说,溶出曲线在现在我们进行的试验中占很大一部分比重,所以高效的测定溶出曲线对于我们现在的工作非常重要。
想要提高效率除了将指导原则烂熟于胸,深刻理解。还有一些小窍门。
小编总结了一下自己的小窍门,分享给大家。
1.尽量采用HPLC法
因HPLC法的线性范围较宽,从第一个取样点到最后一个取样点的样品都可以直接进行测定,尤其对于缓控释制剂取样时间较长,取样点较多,用HPLC法测定可以编辑程序夜间进样,大大提高效率。而采用UV法时,最佳紫外吸收范围是0.2~0.8,有些取样点的样品需要进行稀释才可进行测定,工作比较繁琐。
2.主成分出峰时间控制在5分钟之内
将色谱柱换为短色谱柱或是在不影响杂质与主峰分离度的前提下提高流动相中有机相的比例,将主成分出峰时间控制在5分钟之内。
3.在柱压承受范围内适当提高流速
4.合理安排工作时间与取样点之间的关系
比如缓控释制剂完全可以在工作时间内将前面密集取样点完成。
5.可将各取样点溶出液直接置于液相进样瓶,无需先置于试管再进行转移。
这样不但繁琐,事后还要清洗试管,增加了工作量。
声明:铭研医药对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)







