仿制制剂与原研产品的体内生物等效是评价仿制药质量和疗效一致性的金标准,生物等效性 (BE) 研究既是一致性评价的重点,同时又是一致性评价的难点,需要大量人力、物力、财力资源的投入。
为对我国正在进行的仿制药质量和疗效一致性评价工作提供借鉴和帮助,指导 BE 试验的开展,中国药学会组织专家对美国 FDA《特定药物的生物等效性指导原则》(Guidance for Industry Bioequivalence Recommendations for Specific Products) 的部分内容进行了翻译,中文翻译稿已于 2016 年 5 月 17 日在相关网站 (http://www.nifdc.org.cn/fzy/CL0847/8078.html) 上发布,供业内人士参考。
其中涉及“2018 年底前须完成仿制药一致性评价品种目录”( 以下简称“289 目录”) 的品种共计 185 个。笔者跟进了该 185 个品种的BE 试验指导原则在 FDA 网站 (https://www.fda.gov/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm075207.htm) 上从 2016 年 6 月至2018年12月的更新情况,发现其中的 10 个品种有修订,2 个品种有新增,11 个品种发布了最终版本。
本文对相关品种的更新情况进行了介绍,以期作为已发布的 BE 试验指导原则中文翻译稿的补充。
以一致性评价申报人气最高的阿莫西林胶囊为代表的抗感染药物,在 289 目录中占据了 44 个席位。 其中批准文号超过 200 个的品种有诺氟沙星胶囊 (690)、红霉素肠溶片 (599)、利福平胶囊 (532)、头孢氨苄胶囊 (348)、头孢拉定胶囊 (246)、阿莫西林胶囊 (228)、琥乙红霉素片 (201) 等 7 个。
在美国 FDA 生 物等效性指导原则 2016 年 6 月至今的更新中,虽然修订品种和新增品种均未涉及抗感染药物,但对其修订原则的理解,有助于我国在开展抗感染药物一致性评价中 BE 试验的设计。
修订品种
2016 年 6 月至今,共有 10 个品种的 FDA 生物等效性指导原则进行了修订 ( 详见表 1)。
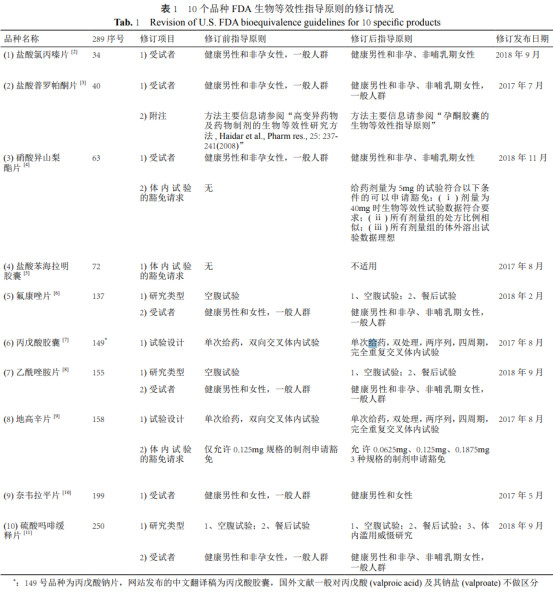
由表 1 可见, 修订项目主要集中在受试者、体内试验的豁免请求、 研究类型、试验设计等 4 项。
1 受试者
盐酸氯丙嗪片、盐酸普罗帕酮片、硝酸异山梨酯片、氟康唑片、乙酰唑胺片、硫酸吗啡缓释片的女性受试者均由“非孕女性”修订为“非孕、非哺乳期女性”。
通过对比 FDA 同时期修订的非 289 目录品种的 BE 试验指导原则可知,多个品种的女性受试者均与上述 6 个品种的修订相同,说明 FDA 在女性受试者的筛选上较之以往更加的谨慎和严格。
2 体内试验的豁免请求
在此次修订中,硝酸异山梨酯片对 5mg 规格符合条件的制剂增加了体内试验的豁免请求;盐酸苯海拉明胶囊对体内试验的豁免请求明确了“不适用”;地高辛片在修订前仅允许 0.125mg 规格符合条件的制剂申请豁免,修订后允许 0.0625、0.125 和 0.1875mg 3 种规格符合条件的制剂申请豁免。
经查,硝酸异山梨酯片在 289 目录中的规格为 5mg,按照修订后的 BE 试验指导原则,可以申请 BE 豁免。
地高辛属窄治疗指数药物,临床上对于肝肾功能减退的老年人,推荐从小剂量 (0.0625mg) 开始,按照肌酐清除率调整给药剂量。肌酐清除率在 8~25mL/min 时推荐 0.125mg,在 26~49mL/min 时推荐 0.1875mg,在 50~79mL/min 时推荐 0.25mg。FDA 对该品种增加允许申请 BE 豁免的制剂规格,有助于促进更符合临床需要的产品的开发。
3 研究类型
在修订后的 BE 试验指导原则中,氟康唑片、乙酰唑胺片增加了餐后试验 ( 修订前仅进行空腹试验 ), 硫酸吗啡缓释片还增加了体内滥用威慑研究 ( 修订前仅进行空腹试验和餐后试验 )。
笔者注意到,乙酰唑胺片的 FDA 生物等效性指导原则的修订发布日期是 2018 年 9 月,而国家食品药品监督管理总局药品审评中心于 2018 年 5 月 25 日 发布了 2018 年第 32 号通告,附件中发布了可豁免或简化人体 BE 试验品种,乙酰唑胺片可豁免餐后 BE 研究。
从时间上看,药品审评中心允许豁免餐后试验在先,而 FDA 增加餐后试验在后;从合理用药上看,乙酰唑胺片在药品说明书中通常建议与食物同服以减少胃肠道反应,因此建议在一致性评价中,对该品种豁免餐后 BE 研究的合理性再做评估。
对于硫酸吗啡缓释片,修订后的 BE 试验指导原则增加了体内滥用威慑研究 (in vivo abuse deterrence study)。吗啡属阿片类药物,阿片类药物滥用在全球已成为严重的公共卫生问题,而防滥用阿片类制剂可不同程度地阻止滥用。
FDA 为鼓励、支持和加速研发可遏制滥用的阿片类产品,于 2013 年 1 月 9 日公布了“防滥用的阿片类药物—评价和说明书”指导原则 ( 草案 ),并于 2015 年 4 月 1 日在《联邦记事》中通知了最终指南的发布。
由于 FDA 已经确定硫酸吗啡缓释片的参比制剂 (RLD) 具有预期能够阻止滥用的特性,依据 FDA 发布的“评价口服固体阿片类药物仿制药滥用威慑的一般性原则” (general principles for evaluating the abuse deterrence of generic solid oral opioid drug products) 的要求,应证明在所有可能的滥用途径下,仿制制剂具有不低于参比制剂的防滥用措施,将仿制制剂滥用的风险降到最低。
推荐进行空腹条件下仿制制剂和参比制剂的鼻腔给药药动学 (PK) 比较研究,可使用吹气方式进行第 2 级 ( 药动学 ) 滥用评估。
采用单次给药,双处理,两周期交叉试验设计,60mg 给药剂量,选择非依赖性消遣阿片类药物使用者或一般人群作为受试者。测定相关的 PK 参数,包括最大峰浓度 (Cmax)、曲线下面积 (AUC0~t 和 AUC0-∞)、达峰时间 (Tmax),以及部分截取的 AUC( 例如 AUC0~3h 和 AUC0~4h) 作为支持性数据。
4 试验设计
丙戊酸胶囊、地高辛片的试验设计均由“单次给药,双向交叉体内试验”修订为“单次给药,双处理,两序列,四周期,完全重复交叉体内试验”, 符合 FDA 于 2012 年 12 月,在以华法林钠为参阅标准发布的生物等效性指导原则中,对窄治疗指数药物生物等效性试验所做的修订。
对于窄治疗指数 (narrow therapeutic index, NTI) 药物,FDA 定义为“药物剂量或血药浓度的微小差异就可以能导致严重治疗失败和 ( 或 ) 药品不良反应的药物,即可危及生命或导致持久的或明显的残疾或失能”。
在 2017 年 8 月发布修订的生物等效性指导原则中,丙戊酸、地高辛均被 FDA 定义为 NTI 药物。
2010 年以前,FDA 制定的特定药物 BE 试验指导原则,对 NTI 药物的试验设计和生物等效限要求与非 NTI 药物相同。
2010—2011 年,FDA 对 NTI 药物的生物等效限的 90% 置信区间如何设置更合理进行了一系列的研究,对比了直接收窄生物等效限标准的方法和根据参比制剂的变异性收窄生物等效限标准的方法,即参比制剂标度平均生物等效性法 (reference-scaled average bioequivalence, RSABE),认为后者更加合理。
综合 NTI 药物特性和临床应用的风险,FDA 建议使用 RSABE 法,以对比仿制制剂和参比制剂的个体内变异 (within-subject variability, WSV) 情况,并同时保留了非标度的平均生物等效限来确定各个 PK 参数的生物等效,即所有的 BE 试验 既要通过参比制剂标定的生物等效限又要通过常规的非标定生物等效限。
对于试验设计,从 2012 年开始,FDA制定和修订的特定药物BE试验指导原则中, 对 NTI 药物推荐采用单次给药,双处理,两序列, 四周期,完全重复交叉体内试验,以准确估计个体内变异 。
对于 NTI 药物的生物等效性评价,我国目前暂无相关的指导原则,也未见官方公布的 NTI 药物目录。2015 版中国药典四部“药物制剂人体生物利用度和生物等效性试验指导原则”提出“对于治疗指数窄的药品的特殊情况,AUC 的可接受区间应该被缩窄为 90.00%~111.11%,在 Cmax 对安全性、药效或药物浓度监测特别重要的情况下,该参数也适用于 90.00%~111.11% 的接受限”。
作为开展仿制药质量和疗效一致性评价的指导性技术文件,原国家食品药品监督管理总局在 2016 年第 61 号通告附件中发布了《以药动学参数为终点评价指标的化学药物仿制 药人体生物等效性研究技术指导原则》,指出“对于窄治疗窗药物,应根据药物的特性适当缩小 90% 置信区间范围”,但未推荐 NTI 药物的生物等效性试验设计方案。
据笔者粗略统计,289 目录内被美国 FDA、加拿大卫生局 (HC)、欧盟 EMA、日本 PMDA 等国际上主要药品监管机构收入 NTI 药物目录的品种大致有 17 种,包括氨茶碱、卡马西平、克林霉素、炔雌醇、锂、苯妥英、哌唑嗪、茶碱、丙戊酸、华法林、 左旋甲状腺素、环孢素、地高辛、氯硝西泮、甲氨蝶呤、苯巴比妥、格列本脲等。
经查询国家食品药品监督管理总局药品审评中心官方网站的一致性评价信息公开,截至 2018 年 11 月 30 日,上述 17 个品种中仅克林霉素 1 个品种有 1 家企业的 2 个规格胶 囊产品于 2018 年 11 月 20 日通过了一致性评价,该企业是该品种首家通过一致性评价的企业。可见绝大部分 NTI 药物的一致性评价目前仍处于进行中甚至观望中。
说明一方面业内人士针对 NTI 药物的生物等效性评价亟需开展深入细致的研究和探讨,另一方面有关部门亦应尽早出台相关的指导原则,以促进 NTI 药物一致性评价工作的开展。
5 其他修订
笔者注意到,对于盐酸普罗帕酮片和氟康唑片两个品种, FDA 分别于 2011 年 10 月和 2008 年 5 月发布了最终版本。但 2018 年 2 月 8 日,FDA 在其网站上更新了收回已发布最终版本的品种列表,上述两个品种分别于 2017 年 7 月和 2018 年 2 月被收回, 并同期重新发布了修订稿。
盐酸普罗帕酮片属高变异药物 (highly variable drug),FDA 从 2004 年起对高变异药物开展了大量研究,2008 年决定对高变异药物采用参比制剂校正的平均生物等效性试验方案。
在大量研究的基础上, FDA 于 2010 年 4 月发布了第一个高变异药物孕酮胶囊的 BE 试验指导原则,并于 2011 年 2 月对其进行了修订,作为在此之后修订或新增的高变异药物的评价方法参阅信息。
2017 年 7 月被收回并重新发布的盐酸普罗帕酮片 BE 试验指导原则,即为“附注” 中评价方法参阅信息的变更。
新增品种
1 地西泮片
2018 年 9 月,FDA 新增了地西泮片的 BE 试验指导原则。推荐开展空腹和餐后两项研究,采用单次给药,双向交叉体内试验设计,10mg 给药剂量,选择健康男性和非孕、非哺乳期女性或一般人群作为受试者。
地西泮属长半衰期药物,由于清除半衰期较长,研究中应确保交叉试验的每次给药间有充分的洗净期。同时也可以考虑采用平行试验设计。
对于药物分布和清除个体内变异较小的长半衰期药物,可以选择使用 AUC0~72h 来代替 AUC0~t 或 AUC0~∞。无论是交叉试验还是平行试验,均应确保足够的样品采集时间以完成药物在肠道内的转运和吸收。
研究中应采集足量的血液样本来充分地描述 Cmax 和达峰时间 Tmax 的特征。指导原则还允许 2 和 5mg 规格符合条件的制剂提出体内试验的豁免请求。
根据国家食品药品监督管理总局于 2017 年 8 月 21 日发布的“关于企业开展 289 目录内仿制药质量和疗效一致性评价基本情况信息”的统计汇总, 截至 2017 年 5 月 23 日,国内持有地西泮片文号的生产企业总量为 121 家,经摸底调研确定不放弃评价的企业数量为 71 家,约占 59%,已开展评价的企业数量为 32 家,在不放弃评价的企业中占比不到一半。
但笔者查询国家食品药品监督管理总局药品审评中心官方网站的一致性评价信息公开后发现,截至 2018 年 11 月 30 日,尚无任何企业的产品通过一致性评价。
地西泮片收载于最新版的各国药典 ( 中国药典 2015 年版、美国药典 40 版、英国药典 2018 年版、日本药典 17 版 ) 中。经比较,各国药典的分析方法及质量标准存在差异,主要表现在有关物质、溶出度、含量等几个关键质量属性上。
说明该品种一致性评价进展缓慢,一方面受到药学研究环节的制约,另一方面生物等效性研究特别是长半衰期药物 BE 试验的复杂性更增加了该品种一致性评价的难度。
FDA 新增了地西泮片的 BE 试验指导原则,为相关企业开展该品种的生物等效性试验提供了借鉴和帮助,相信会在一定程度上加速该品种一致性评价工作的推进。
2 硫酸吗啡缓释片
2018年9月,FDA修订了硫酸吗啡缓释片(100mg) 的 BE 试验指导原则,同时新增了该品种 60mg 规格的 BE 试验指导原则,研究方案、试验设计、受试者、生物等效限、溶出度试验方法和采样次数等均与 100mg 规格的相同,仅给药剂量调整为 60mg。
硫酸吗啡缓释片为强效镇痛药,主要适用于晚期癌症病人镇痛。本品同时具有明显的镇静作用和对呼吸中枢的抑制作用,使其对二氧化碳张力的反应性降低,过量可致呼吸衰竭而死亡。
在使用说明书中有“药物过量”的叙述“吗啡过量可致急性中毒, 成人中毒量为 60mg,致死量为 250mg”。虽然迄今 为止国内外临床资料尚无吗啡最高限制剂量的报道, 但受本品个体差异较大的影响,在临床上单次口服吗啡缓释制剂 <100mg,仍引起急性中毒等严重不良反应发生的病例屡见报道。
吗啡制剂口服给药的使用剂量是 30mg/ 次,100mg/d。FDA 对该品种增加 60mg 规格的 BE 试验指导原则,有助于降低健康受试者在生物等效性研究中的风险。同时也要求提前给予纳曲酮,以最大程度阻断阿片受体,消除所有阿片药物相关不良事件的风险。
发布最终版本品种
除修订了盐酸氯丙嗪片等 10 个品种,新增了地西泮片等两个品种的生物等效性指导原则外,FDA 于 2017 年 8 月还发布了 11 个品种的生物等效性指导原则的最终版本,这11个品种是:
盐酸乙胺丁醇片(28 号 )、盐酸克林霉素胶囊 (46 号 )、阿替洛尔片 (51 号 )、 盐酸维拉帕米片 (84 号 )、氢化可的松片 (85 号 )、克 拉霉素片 (98 号 )、氯硝西泮片 (131 号 )、盐酸多塞平胶囊 (136 号 )、氨苯砜片 (182 号 )、阿莫西林克拉维酸钾片 (244 号 ) 和醋酸去氨加压素片 (287 号 )。
结语
FDA 从 2010 年 6 月开始陆续公布并持续更新的 《特定药物的生物等效性指导原则》,是我国开展仿制药质量与疗效一致性评价的重要参考。
通过对 289 目录内品种从 2016 年 6 月至今的更新情况的研究和分析,可以看出美国 FDA 在生物等效性研究方面对体内试验的豁免、餐后 BE 研究等越来越具体到品种,更加科学;更关注受试者的健康,如增加更严谨的受试者入选条件,采用更低的给药剂量等;同时对于窄治疗指数药物、高变异药物、长半衰期药物的生物等效性试验方案设计、统计学方法等,始终在进行研究和探讨。这些都是值得我们学习和借鉴的。
文章来源:《中国抗生素杂志》2019 年 3 月第 44 卷第 3 期
作者:薛晶 南楠 刘倩 许鸣镝( 中国食品药品检定研究院)
声明:药研江湖对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)






