我国是仿制药大国,在现有约17万个药品批准文号中,属于化学药品的约有10.7万个,其中95%以上是仿制药。
然而,作为仿制药生产和使用大国,我国仿制药生产领域长期以来缺少高水平的质量标准和质量控制体系,全行业普遍低成本运行,导致获批上市的部分仿制药与原研药相比质量普遍存在差距,药品质量仍有较大提升空间。
与欧美日等发达国家推行的质量源于设计(QbD)理念相比,尽管在过去的几年里国家药品监督管理部门一直在大力倡导建立“以审评为主导、检查检验为支撑的药品技术审评体系”,但不可否认我国目前的药品质量监管实际上总体还是以检验为核心手段。
我国除了特有的药品注册检验和批准生产前检验之外,还有全球规模最大的年度上市后药品质量监督抽验机制。
自2008年规范国家上市药品质量监督抽验机制以来,在国家药品监督管理局的领导下,中国食品药品检定研究院组织全国40余个省级和副省级药品检定机构,每年抽验上百个品种约2万多批次药品,按照《中华人民共和国药典》标准进行法定标准检验,国家年度投入经费达到1.7亿元。
无论是抽检的品种数量、批次,还是参与的药检机构数量以及投入经费,都达到了全球最大规模。但是,不论是注册检验、批准生产前检验还是国家药品质量监督抽验,都仅是根据企业拟定质量标准或者药典质量标准规定的限度给出“合格”或“不合格”2种结论,并没有对每批样品之间的质量特性和质量差异予以研究和体现。
另外,虽然我国目前在大力推进仿制药一致性评价,但是鲜有人对不同企业的相同仿制药产品质量之间是否存在差异进行过定量的横向分析研究。
本研究采用定量分析手段对我国仿制药质量之间是否存在差异进行了实证研究。收集2014—2018年国家药品质量监督抽验数据,在对数据进行整理、分类和清洗的基础上,采用多因子广义线性回归法,对原研药和不同生产企业的仿制药的溶出度和含量测定的变异性2个关键质量属性进行定量分析研究,探求原研企业、上市企业、出口企业以及有产品通过一致性评价的企业的产品之间是否存在质量差异,为促进我国制药企业高质量发展,为政府支持行业重点发展提供意见建议。
研究假设
药品是制药企业的终产品。对于评价一个上市药品质量来说,除了满足国家药品质量标准和企业内控质量标准外,另一更重要的参数是药品的批间一致性和变异性。通过对上市药品批间一致性和变异性的考察,可以反映出生产企业的制剂研发能力、生产工艺、药品生产质量管理规范(GMP)实施水平以及产品在流通运输过程中的条件控制水平。
本研究中,在分析2014—2018年国家药品质量监督抽验数据的基础之上,通过考察重点质量参数在不同批次产品之间的一致性和变异性,实证分析探究不同类型生产企业在药品质量上是否有差异。
根据研究目的,重点探讨不同企业类型药品质量的差异,因此提出以下研究假设:①原研企业的产品质量更优。②有过一致性评价企业的产品质量更优。③制剂出口型企业的产品质量更优。④上市企业的产品质量更优。
资料来源
研究采用2014—2018年国家药品质量监督抽验数据,共涉及2649个生产企业的768个品种共11.3万批次的110万条检验数据。
研究选择化学药品口服固体制剂,提取年份、药名、检验所、企业、批号、含量测定、溶出平均等条目进行合并整理,计算药品检验数据中含量测定变异系数及溶出度平均变异系数,标注原研厂家、通过一致性评价的厂家、制剂出口型企业以及上市公司,形成2014—2018年国家药品评价性化学药品口服固体制剂数据库。
研究变量
药品质量差异的评价指标
变异系数(coefficientofvariation,CV)是原始数据标准差与原始数据平均数的比,可以消除测量尺度和量纲的影响。变异系数反映数据离散程度的绝对值,其数据大小不仅受变量值离散程度的影响,而且还受变量值平均水平大小的影响。
变异系数的公式(式1):CV=[标准偏差(SD)/平均值(Mean)]×100%
本研究主要从两方面测量仿制药质量的变异程度:
①含量测定变异系数:在控制药品检验所、药品厂家、药品通用名下,计算多次药品含量测定的标准差/多次药品含量测定的平均值,即为相同企业相同通用名下不同批次之间的含量差异。
②溶出度变异系数:在控制药品检验所、药品厂家、药品通用名下,计算多次药品溶出度测定的标准差/多次药品溶出度测定的平均值,即为相同企业相同通用名下不同批次之间的溶出度差异。
影响药品质量差异的控制变量
研究中的自变量均为二分类变量,分别为是否为原研厂家、是否有通过一致性评价产品的企业、是否为制剂出口型企业、是否为上市公司。
原研厂家根据国外top100中的企业进行匹配,通过一致性评价产品的企业根据丁香园药品中一致性评价数据库中通过一致性评价产品的企业进行匹配;上市公司通过我国A股上市企业进行匹配;制剂出口型企业根据我国医药进出口商会发布的4期制剂出口型企业进行匹配。
分析方法
非参数检验
由于本研究中药品含量测定变异系数、溶出度变异系数等分布非正态,因此采用Mann-WhitneyU检验对非正态分布定量资料进行单因素分析。
广义线性回归
传统的线性回归模型对连续变量进行分析时,存在着严格的限制,如要求线性、满足正态分布和方差齐性,而本研究中,药品含量测定、溶出平均等的分布并不满足正态性,因此我们采用广义线性回归模型,连接函数选择对数函数。回归模型如下:
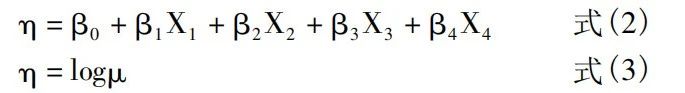
其中,μ代表检验药品的含量测定变异系数、检验药品的溶出变异系数,X1代表是否为原研厂家、X2代表是否有通过一致性评价产品的企业、X3是否为制剂出口型企业、X4是否为上市公司,β0为常数项,β1,β2,β3和β4为系数。本研究采用Excel进行统计数据,P<0.05表示有统计学差异,使用SPSS23进行非参数检验的分析,使用stata14进行广义线性模型的分析。
研究结果
样本总体情况
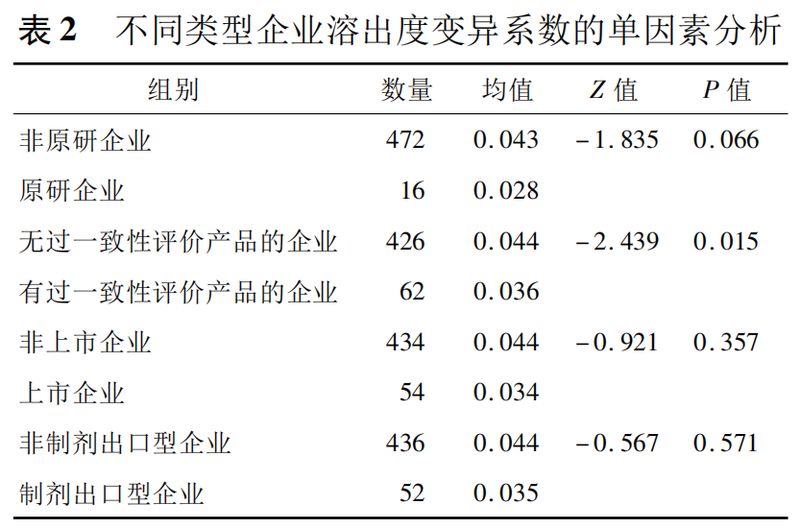
研究收集了2014—2018年的5年国家药品监督抽验数据,选择化学药品固体口服片剂,经过数据提取和整理后,形成2014—2018年国家抽检片剂数据库,共包含113个片剂品种,934家药品企业,经计算每药品每家企业的变异系数后,最终得到1167条数据,其中有含量测定变异系数的数据为779条,有溶出度变异系数的数据为488条。各不同类型企业的数量见表1和表2。

单因素分析结果
各不同类型企业含量测定变异系数的单因素分析结果见表1,结果发现:
①原研药企业与非原研药企业的药品在含量测定变异系数上有显著差异(P<0.05),原研企业含量测定的变异系数小于非原研企业(0.011vs0.020)。
②有过一致性评价产品的企业与没有过一致性评价产品的企业的药品在含量测定变异系数上有显著差异(P<0.05),有过一致性评价产品的企业的含量测定变异系数小于无过一致性评价产品的企业(0.017vs0.021)。
③上市企业与非上市企业的药品、出口型企业与非出口型企业的药品在含量测定变异系数上无显著差异(P>0.05)。
各不同类型企业溶出度变异系数的单因素分析结果见表1和表2,结果发现:
①原研企业与非原研企业的药品在溶出度变异系数无显著差异(P>0.05)。
②有过一致性评价产品的企业与没有过一致性评价产品的企业的药品在溶出度变异系数上有显著差异(P<0.05),有过一致性评价产品的企业的溶出度变异系数小于无过一致性评价产品的企业(0.036vs0.044)。
③上市企业与非上市企业、出口型企业与非出口型企业在溶出度变异系数上无显著差异(P>0.05)。
多因素分析结果
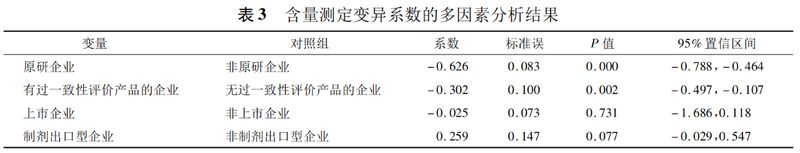
对于含量测定变异系数的广义线性回归分析结果见表3,
结果发现:
①原研企业的药品显著低于非原研企业(P<0.05)。
②有过一致性评价产品企业的药品显著低于无过一致性评价产品的企业(P<0.05)。
③是否为上市企业、是否为制剂出口型企业的药品在含量测定变异系数上无显著影响(P>0.05)。
对于溶出度变异系数的广义线性回归分析结果见表4,

结果发现:
①原研企业的药品显著低于非原研企业(P<0.05)。②上市企业的药品显著低于非上市企业(P<0.05)。③是否有产品通过一致性评价、是否为制剂出口型企业的药品在溶出度变异系数上无显著差异。
讨论
本研究采用国家药品监督抽验数据实证研究,从定量分析的角度探究了不同生产企业药品质量之间是否存在差异。
仿制药与原研药质量确有差异
原研企业的药品在关键的质量参数——含量测定和溶出系数上的变异系数显著低于非原研企业,这表明原研药品质量批间一致性比仿制药好。原研药生产企业在长期连续生产过程中,相对于仿制药生产企业来说,能够将药品的批间差异性控制在一个较小的波动范围之内,从而实现了药品质量更加持续稳定和可靠。
随着全球化进程的加快,全球制药工业结构和供应链也发生了深刻改变。药品研发、原料采购、临床试验、生产操作、出厂放行、包装运输等均突破了国界,实现了全球化。
在这种形势下,如何能将产品关键质量参数的变异性控制在一个尽可能小的波动范围内,如何能够保证产品质量的持续稳定可靠,是一个制药企业在质量管理体系、制剂处方的一致性、生产工艺稳定性、GMP执行合规性和持续性方面好坏的综合体现。
相比之下,我国现在执行的国家药品监督抽验机制,对市场上流通的药品进行抽样,按照《中华人民共和国药典》2015年版收载质量标准进行检验,仅出具“合格”或“不合格”结论的这种做法显得过于“简单粗放”,体现不出药品内在质量特征和质量趋势,也无法对生产企业的生产水平和质量管理体系做出评估。
此外,目前我国仿制药一致性评价工作已进入常态,截至2019年11月底,国家药品监督管理局共审评通过一致性评价123个品种,包括323个品规。前期已开展国家组织药品集中采购和使用的25个品种全部是已通过仿制药一致性评价的药品。
仿制药一致性评价的目的就是为了要实现通过一致性评价的仿制药在质量和疗效上能够替代原研药。但是,现行的做法仅通过比较仿制药与参比制剂(原研药)3组溶出曲线和按照质量标准进行检验来对仿制药质量与参比制剂的一致性做出评价是远远不够的。
和国家药品监督抽验类似,这种做法显得过于“粗放”,即使通过了仿制药一致性评价的产品,也不一定真正能够代表其质量达到了原研药的水平。这样就很容易造成“一次性评价”,而没有真正达到“一致性评价”的目的。
因此,十分有必要针对性地加大对通过仿制药一致性评价的品种的国家药品监督抽验力度,并且不仅是根据抽验数据出具一个“合格”或“不合格”的简单结论,而是要对抽验数据进行深入挖掘和分析,研究比较被抽检仿制药与原研药关键质量参数之间的变异性大小,以及分析通过一致性评价的仿制药的“历史”质量抽检数据,从而较为全面客观地判断通过仿制药一致性评价的产品的质量是否真正“持续稳定”地与原研药达到了一致。
不同企业的相同仿制药产品质量之间有差异
实证研究结果也表明,不同企业的相同仿制药产品质量之间有差异,这些药品在含量测定和溶出度的变异性方面均存在显著差异。
总体来说,研发投入较多、经济实力较为雄厚的企业的仿制药产品的质量要比其他仿制药生产企业的产品质量要好。
是否有产品通过仿制药一致性评价能够在一定程度上体现企业的先进性
研究发现有通过一致性评价产品的企业比没有产品通过一致性评价的企业所生产的药品的含量测定的差异显著较低,说明前者在质量管理体系、制剂处方的一致性、生产工艺稳定性、GMP执行合规性和持续性方面做得更好。从一个侧面也说明了是否有产品通过仿制药一致性评价是一个生产企业综合实力的体现,能够在一定程度上反映出企业的先进性。
综上得到如下结论:①我国仿制药与原研药质量确有差异;②不同企业生产的相同仿制药质量之间也有差异;③是否有产品通过仿制药一致性评价能够在一定程度上体现企业的先进性。
通过对国家药品监督抽验数据进行研究发现,检验结果都是合格的药品在关键质量参数变异性方面存在显著差异。因此建议改进我国现有的药品质量评价模式。
除了优化国家药品监督抽验机制、合理利用分配检验资源外,更重要的是要加大对多年来积累的国家药品监督抽验数据的挖掘利用,多角度、多维度定量分析检验数据所蕴含的质量信息和规律,对不同生产企业的同种药品、同一生产企业不同时期生产的药品的关键质量参数进行分析研究以描述药品的质量差异。
文章来源:《中国新药杂志》
原标题:《我国仿制药品质量差异研究》
作者:许明哲1,陈敬2,3,翟琛琛2,管晓东2,3,张夏1,刘文1,王翀1,朱炯1,史录文2,3(1.中国食品药品检定研究院,北京;2.北京大学药学院,北京;3.北京大学医药国际管理中心,北京)
声明:铭研医药对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)






