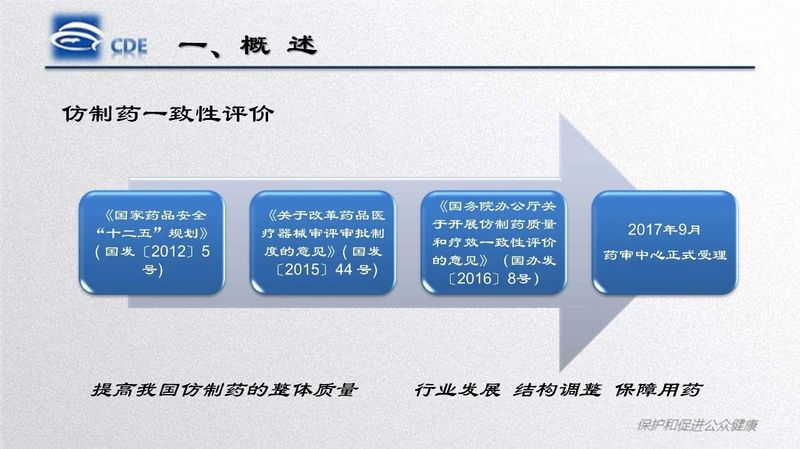
加快推进仿制药一致性评价工作,加强对申请人的培训和宣讲,由中国药品监督管理研究会主办,国家药品监督管理局药品审评中心技术指导的“化学药品仿制药一致性评价技术研讨班”于2019年11月26日至27日在北京举办。
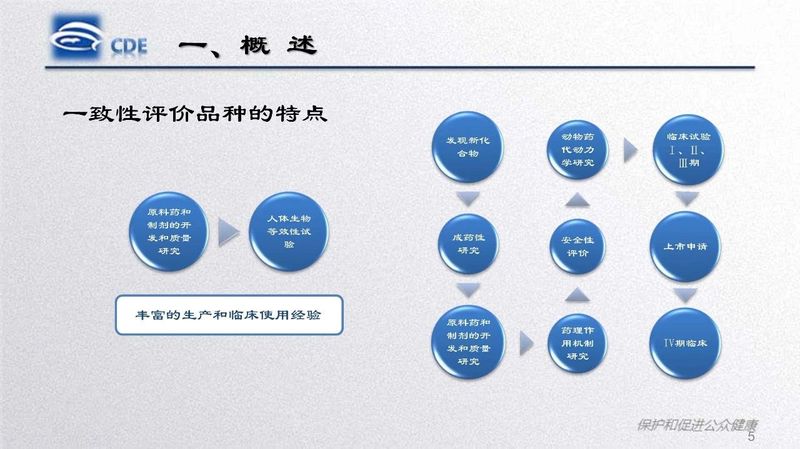
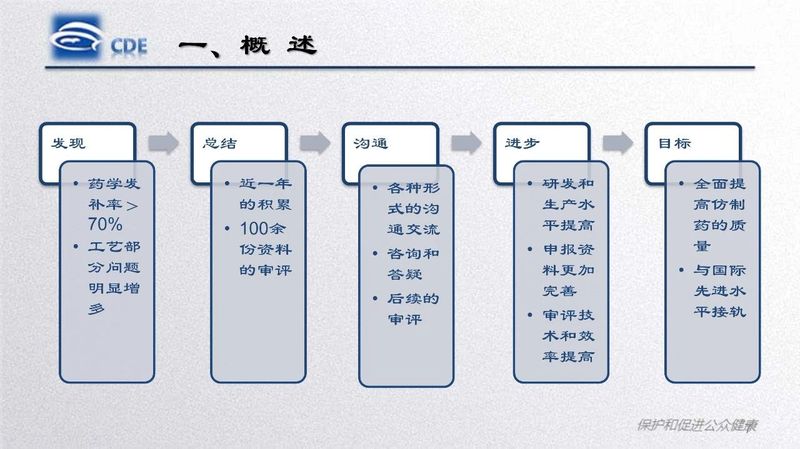
研讨班通过政策法规解读、案例分析、指导原则讲解等形式,总结了化学药品仿制药口服固体制剂一致性评价工作进展情况和相关疑难问题,讲解了化学药品仿制药注射剂一致性评价工作相关文件起草情况和技术要求,介绍了仿制药研究领域ICH指导原则的基本要求和主要考虑,梳理了原辅包关联审评工作程序及相关政策要求。
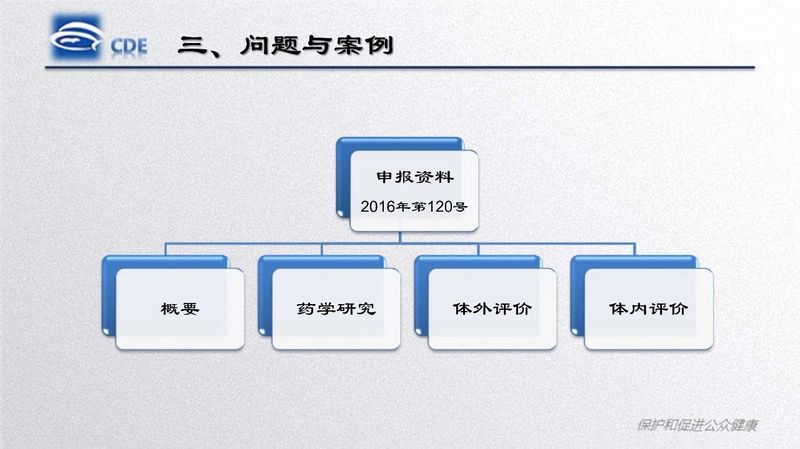
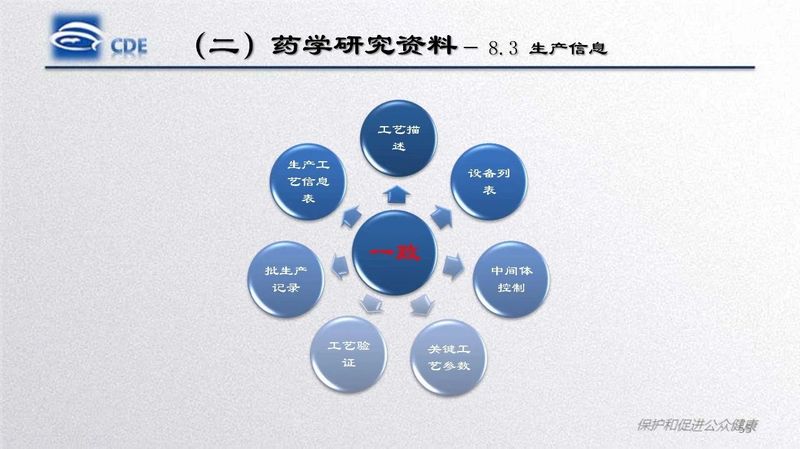
药研君也收集到了相关的PPT资料,今天就给大家分享其中的一篇《口服固体制剂仿制药一致性评价处方工艺研究存在的问题和案例分析》
关注公众号:药研江湖,后台回复“处方工艺研究培训”或者“培训3”,获取本次CDE培训《口服固体制剂仿制药一致性评价处方工艺研究存在的问题和案例分析》PPT资料



































"我有问题问CDE"是一项帮助医药研发企业向CDE老师咨询提问的服务,也是参比购推出的一项免费特色服务,有提问需求的读者可以扫描下方二维码提交问题。

声明:药研江湖对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)








