本人介绍了平衡溶解度的概念及WHO平衡溶解度项目,详细说明了平衡溶解度实验的基本程序和技术要求,分析研究了影响溶解度测定的因素,旨在为科研人员对溶解度实验方案的设计和实施提供参考,规范平衡溶解度实验在BCS分类和生物等效性豁免中的应用。
1 溶解度的概念
根据国际纯粹与应用化学联合会(IUPAC)的定义,溶解度是饱和溶液在指定溶剂中以指定溶质的比例表示的分析组成。溶解度可以用不同的浓度单位表示,如质量摩尔浓度、摩尔分数、摩尔比、质量/体积比等。溶解度通常分为3种:
①动力学溶解度,表示当溶液中刚开始出现沉淀时化合物的浓度;
②平衡溶解度,也称为热力学溶解度,表示饱和溶液中存在过量固体时,溶液和固体处于平衡状态时化合物的浓度,是固体溶解和从溶液中析出的动态平衡过程;
③固有溶解度,是指离子型化合物在某个pH为完全非离子化的游离酸或游离碱时的平衡溶解度。
根据一般溶解度方程(GSE),可以估算药物在水中的固有溶解度(S0)(公式1):logS0=-0.01(MP-25)-logKow+0.5(公式1)MP为熔点(℃),Kow为油水分配系数。方程表明,具有较高熔点以及较高亲油性化合物的水溶解性较低。
如果已知pKa,一般溶解度方程也可与Hender-son-Hasselbalch方程相结合来预测离子化合物的溶解度(公式2):Stot=S0(1+10(pKb-pH)+10(pH-pKa))(公式2)Stot为溶质总的溶解度,S0为固有溶解度,pKa为酸解离常数的负对数,pKb为碱解离常数的负对数。
目前有几种计算软件可以用于估算基于结构的化合物油水分配系数和pKa值,但不足以取代平衡溶解度实验测定。

2 WHO平衡溶解度项目
WHO第40次技术报告“关于豁免WHO基本药物目录中口服固体速释制剂体内生物等效性研究的要求”一章的WHO基本药物目录中,列出了基本药物的溶解性、渗透性、BCS分类及是否符合生物等效性豁免等。
WHO期望将其不断更新作为一个动态文件放在官方网站上。2016年WHO药品标准专家委员会(ECSPP)达成了一致,该目录应是基于验证过的实验室数据,而不是文献数据。
因此2018年WHO组织了一个新的多中心项目,全球十余个国家实验室和大学参加,目的是测定WHO基本药物目录中原料药的平衡溶解度,以确定药物的BCS分类,判断其是否可生物等效豁免。笔者接下来对WHO推荐的平衡溶解度实验的基本程序和技术要求进行详细阐述。

3 基本程序和技术要求
3.1基本原理
根据WHO第51次技术报告“多来源(仿制)药品:建立可互换性注册要求的指导原则”对溶解度的界定,当药物的最高单次治疗剂量在pH1.2~6.8内溶解于250mL或更少的水介质时,可视为高溶,其中最高单次治疗剂量是由有关监管部门决定的,由批准的标签或药品说明书推荐。
药物的pH-溶解度曲线应在(37±1)℃水介质中测定,每个pH条件下至少重复测定3次。一般采用平衡溶解度实验判断药物的溶解性,药物首先溶解或悬浮在缓冲液中,用适当的方法分离之后,测定溶液或上清液的浓度。测定前应记录药物的来源和纯度,有时也需要了解其他特性。
实验是在250mL体积中检测最高单次治疗剂量,也可以考虑等比例缩小体积,特殊情况如药物量不足,且价格昂贵,或当用药典缓冲液无法维持介质的pH值时除外。仪器允许的情况下可采用小体积的溶解度介质(比如50mL)。平衡溶解度的测定方法有许多种,如摇瓶法、酸碱滴定法或其他方法。
应当证明所用方法的合理性,并且有方法学数据的支持。WHO推荐的摇瓶法是基于40年前开发的相溶解度技术,至今仍被大多数人认为是最可靠和最广泛使用的溶解度测定方法。
摇瓶法是使用定轨摇床等机械振荡装置,应能控制保持在(37±1)℃,并设置适当的振荡速率,采用适当的方法验证。振荡速率应根据烧瓶或试管的形状以及溶液的体积进行优化,保证药物颗粒充分接触稀释剂,防止颗粒聚集,并避免形成涡流。
在优化好振荡速率的情况下,一般样品24h内即达到平衡,也有的品种需要72h甚至更长时间,应在几个不同时间点验证样品是否达到平衡。如果药物的润湿性较差,浮在溶解度介质表面的话,可以借助玻璃微珠等工具通过搅拌或超声使颗粒分散。一旦成功达到润湿性,平衡溶解度实验会继续走向平衡。

3.2用于平衡溶解度测定的缓冲液
pH-溶解度曲线应在pH1.2~6.8内测定,药物的溶解度分类是根据上述pH值范围内的最低溶解度。根据研究的可变性,至少在pH1.2,4.5,6.8条件下平行测定3份以上,例如,0.1mol·L-1盐酸溶液或pH1.2模拟无酶胃液,pH4.5乙酸缓冲液以及pH6.8磷酸缓冲液。
以药物的离子化特性为依据来决定pH值的个数,如果已经知道药物在上述pH范围内水介质中的最低溶解度(如pKa),也需要测定在那个pH时的溶解度数值。在相同温度下[如(37±1)℃]调节缓冲液的pH值。
当药物加入到作为溶剂的缓冲液中,此时溶剂的pH值需要用校准过的pH计进行验证,实验结束后需要再次验证pH值。如果缓冲液与溶质结合后pH发生了改变,可用适当的酸或碱溶液调节pH值,或者使用更强缓冲能力的缓冲液。
调节pH值后,缓冲液需要至少平衡1h后再加入样品。WHO推荐的缓冲液配制方法如下,相关试剂的配制可查阅《国际药典》:pH1.2缓冲液:称取2.52g氯化钠,加入900mL水使溶解,用盐酸溶液(约70g·L-1)调节pH值为1.2,再用水稀释至1000mL。
pH4.5缓冲液:称取2.99g乙酸钠,加入900mL水使溶解,用醋酸溶液(约120g·L-1)约14mL调节pH值为4.5,再用水稀释至1000mL。pH6.8缓冲液:称取6.9g磷酸二氢钠和0.9g氢氧化钠,加入800mL水,用氢氧化钠试液(约80g·L-1)调节pH值为6.8,再用水稀释至1000mL。

3.3预实验
建议根据药物特性进行预实验,初步评估达到平衡的时间、预期溶解度以及关键实验需要的样品量。在5mL(或选定的体积)pH1.2,4.5和6.8缓冲液中加入过量30%~40%的固体,测定溶液中固体的量。
如果使用5mL缓冲液的话,可将固体加入10mL试管中。缓冲液体积的确定对应于预期的最小溶解度,如果溶解度大于预期值,则将体积减小至3mL;如果预期溶解度低且样品量足够,则使用更高的体积。或者体积保持在5mL,通过增加或减少样品量调整。
检查是否有未溶解的固体;如果固体完全溶解至缓冲液中,应向试管中添加额外的固体直至有固体保持不溶解的状态为止。解决与固体润湿性或聚集有关的任何潜在问题,可在试管中加入玻璃微珠后机械振摇或磁力搅拌。
制成饱和溶液后,每个pH至少制备3份样品,在不同时间点取样测定溶质的溶解量。建议在约6个时间点(比如2,4,8,24,48,72h)测定溶液的浓度直至每次测定之间不再有显著差异,以确定药物达到平衡所需要的时间。
取出溶液后须立即过滤样品(如使用0.45μm滤膜)或离心分离未溶解的样品,当介质体积小时建议采用过滤的分离方式,离心也是一种有效的替代方法。溶解度实验是在(37±1)℃条件下操作,如果分析测定之前需要将样品在室温下放置,则样品离心或过滤后应立即稀释,以避免溶质析出。
到达药物浓度随时间变化的平台期所需的最短时间可认为是合适的平衡时间。确定达到平衡的时间后,应再次测定缓冲液的pH值。
3.4稳定性
应监测药物在pH范围内的稳定性,以测定真实的溶解度。如有收载的话,采用国内外药典确认过的分析方法分析药物及其降解产物,比如高效液相色谱法(HPLC)、分光光度法或其他确认过的分析方法。
因HPLC可用于杂质和不稳定性的检测,故与分光光度法相比,建议优先选择HPLC。应当关注缓冲液组成或pH是否会导致药物的降解。如果没有适合的稳定性分析方法,则需要进行单独的稳定性实验以证明样品在缓冲液介质中是稳定的。

3.5分析方法
建立标准曲线,最好使用5~6个浓度水平作线性回归,估算截距、斜率和相关系数,使用另外3个控制浓度点独立评估精密度和准确度。如有必要,稀释后的样品应在标准曲线的范围内,记录稀释因子进行反算。
每份样品进2针并建立标准曲线。预计至少运行3~4次分析(例如,首先是2,4,8h的样品,然后可能还需要另外3次24,48和72h的样品),这取决于样品的稳定性。最后对数据进行日内、日间精密度和准确度的评估。一般情况下,控制浓度点和样品是穿插进样的。
为了考察过滤的影响,控制浓度点可以在过滤前后分别进样。回收率应在98%~102%之间( 如果小于这个值表明发生了滤膜吸附;如果大于这个值表明滤膜的成分在影响分析)。有必要的话可以更换过滤方式。评估专属性,线性,范围,准确度,重复性和中间精密度,应符合最低接受限度。
3.6关键实验
根据预实验的结果设计关键实验。下列步骤是进行关键溶解度实验的一般例子:
①每个pH条件需平行3份进行评估,称取约过量10%的样品(通过预实验确定)置烧瓶中,加入适当体积的缓冲液(至少pH1.2,4.5,6.8缓冲液3种);
②混匀后测定pH值;
③设置摇床的温度和振荡速率,把烧瓶放入摇床中固定;
④根据预实验评估的平衡时间,取出一部分悬浮溶液;
⑤立即过滤或离心分离未溶解的样品;
⑥记录实验结束时溶液的pH值;
⑦定量分析前尽快稀释样品,避免析出;
⑧测定药物的浓度。
3.7结果报告
溶解度以mg·mL-1表示。每个实验条件重复溶解度结果的相对标准偏差(RSD)应不大于10%剂量-溶解度体积(DSV)表示在观察到溶解度最低的pH条件下,完全溶解药物的最高单次治疗剂量所需的溶液体积。DSV可以通过将药物最高单次治疗剂量(mg)除以研究中测得的溶解(mg·mL-1)计算得到。当DSV在整个pH1.2~6.8内小于250mL时,药物被认为是高溶。
4 影响溶解度的因素
药物的溶解度不仅受药物的比表面积、粒度、晶型等物理化学性质的影响,还受介质的性质影响,如pH、极性、表面张力、添加表面活性剂、助溶剂、盐等,而且受温度和振荡时间等溶解度实验参数的影响。表1是一些已发表的水溶解度数值变异范围大的例子。

4.1缓冲液的组成
选择溶解度测定的介质与其应用有关,当结果旨在预测吸收或生物利用度时,建议使用一种生物相关的介质溶液;当结果旨在支持溶出方法开发时,建议使用溶出介质。当评估化合物的pH依赖性时,建议缓冲液在一个宽的pH范围内控制离子强度和反离子类型。弱酸和弱碱在介质中的离子化程度取决于化合物的pKa值和介质的pH。
4.2过量固体的量
药物在溶液中达到平衡需要加入过量的固体,过量固体的量是否会影响平衡溶解度数值目前还没有确定的结论。Kohsaku等考察了过量固体对吲哚美辛平衡溶解度的影响,pH5和6时平衡溶解度随过量固体的量增加而减少,pH6.5和7时则相反,平衡溶解度随过量固体的量增加而增加。
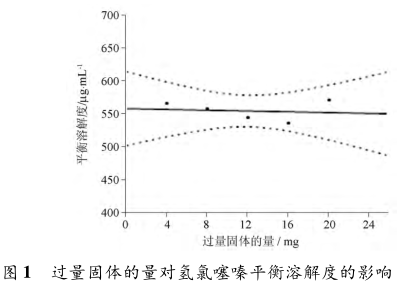
Edit等测定了每5mL介质中分别过量4、8、12、16、20mg时氢氯噻嗪的平衡溶解度(图1),结果则没有显著差异。建议为了避免取样困难,过量固体的量在保证足够的基础上不宜太多,例如每5mL介质过量5~10mg即可。
4.3温度
众所周知,溶解度与温度有关,因此平衡溶解度实验必须在恒定温度下进行。由于药物有吸热溶解的过程,溶解度会随温度的升高而增加,故大多数药物在体温37℃时的溶解度会高于室温25℃的溶解度。这在药物设计中是一个优势,可以预期体内有更好的生物利用度。因此体温和室温条件下测定得到的平衡溶解度数值是非常有用的数据支持。
4.4振荡时间
振荡是摇瓶法达到平衡的重要步骤,振荡时间越长,药物的溶解度越大,因此严格应用摇瓶法的话,应首先确定药物达到平衡所需要的振荡时间再测定溶解度。
4.5沉降时间
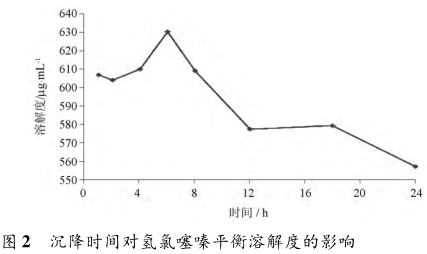
振荡溶解后,需将多余的固体完全沉降后取上清液。研究表明,沉降时间对平衡溶解度的测定结果亦有影响。Edit等考察了分别沉降1~24h后取样测定,结果有些出人意料。沉降1~8h测定的氢氯噻嗪溶解度数值较大,以沉降6h最大。而12h以后的溶解度却显著减小,有待考察是否由于测定误差导致,见图2。
4.6相分离技术
相分离技术是摇瓶法测定的关键部分。振荡溶解后,溶液和固体两相需要分离后取上清液进行HPLC或UV等分析测定。取出的上清液必须完全澄清,不含任何固体粉末。
自然沉降被认为是最安全的相分离技术,但其耗时长,且当化合物形成胶束或聚合物产生乳白色溶液时,溶液则难以澄清,对于这种样品,只有通过离心的方法来解决,因此离心或过滤的相分离技术也是一种很好的选择。
然而选择离心或过滤时有时可能会造成测定的平衡溶解度数值比真实值高,分析原因有:
①振荡过程中有可能形成过饱和溶液,停止振荡后立即过滤或离心导致结果偏高;
②溶液中悬浮的粒子可能小于滤膜的孔径,导致滤液的浓度偏高;
③固体粉末较为松散的话,离心后取上清液时可能会混入粉末,造成溶解度测定结果偏高。

5 小结
目前测定平衡溶解度没有公认的标准方法,由于实验方法不同,导致了同一药物不同来源的BCS分类存在差异。本研究详细阐述了平衡溶解度实验的基本程序和技术要求,分析研究了影响溶解度测定的多方面因素,以规范平衡溶解度实验在BCS分类和生物等效性豁免中的应用,希望对我国仿制药质量与疗效一致性评价工作的顺利开展起到积极的作用。
来源:《中国药学杂志》
原标题:《平衡溶解度实验基本程序和技术要求》
作者:熊婧 ,张涛 ,许明哲 ,金少鸿
声明:铭研医药对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)







