1995 年美国密西根大学的 Amidon 等指出药物的口服吸收主要受药物在胃肠道溶解度或溶出速度与跨膜渗透能力的影响,并首次提出了生物药剂学分类系统 (biopharmaceutics classification system,BCS) 的概念,将药物按照体外溶解性 (solubility) 和肠道渗透性 (permeability) 分为 4 类,用于区分不同性质药物口服吸收的特点。

在 BCS分类系统中,高溶解性是指药物最大剂量能在 37 ℃,pH 1~7.5 内,在体积≤250 mL 的水性缓冲液介质中完全溶解,反之为低溶解性;
高渗透性是指药物在胃肠道稳定存在的情况下吸收达90% 以上,否则为低渗透性。
BCS分类系统的提出为现代药剂学和生物药剂学的发展起到了重要的指导作用。其中BCS II类药物表现为低溶解性/高渗透性。
通过组合化学及高通量筛选等方法得到大量候选药物中,有超过 40% 的化合物为低溶解性,增加这些药物的溶解度是提高其成药性的重要手段。
由于实际测定中要完全排除药物解离和溶剂的影响不易做到,通常对于药物溶解度的测定数值多是平衡溶解度 (equilibrium solubility) 或表观溶解度 (apparent solubility)。
常用的增加药物表观溶解度的方法有:生成可溶性盐类;改变晶型/形成溶剂化物、共晶;表面活性剂增溶;减小粒径;采用潜溶剂/助溶剂;制备固体分散体;形成包合 物;设计成纳米给药系统等 。
尽管这些方法可以显著增加药物的溶解性,但对药物口服吸收的提高非常有限。可能的原因是在增加药物表观溶解度的同时忽略了药物渗透性的改变 (升高、不变或降低)。
药物溶解性与渗透性的关系可由药物的跨膜渗透系数公式分析得出,此公式如下:

其中,D为药物跨膜扩散系数,K为药物在胃肠壁膜/胃肠道水环境的分配系数,h 为跨膜厚度。该公式描述了单位时间内药物渗透进入肠壁的深度。
由此可见,由于药物渗透性与膜/水分配系数相关,后者又受溶解度的影响,从而使药物溶解性和渗透性存在独特的关联性 。
然而,长期以来药学界对溶解性与渗透性这一对有着密切关联的药物性质一直保持着相对独立的研究。
近年来研究提示,由于制剂增加BCS II类药物表观溶解度的同时很可能会导致渗透性降低,这种独立研究可能会对提高药物口服吸收不利。
因此,本文综述了近年来关于溶解性与渗透性的关联性研究,对研究相对较多的几种增加表观溶解度的制剂策略如环糊精包合物、表面活性剂增溶、潜溶剂、固体分散体进行了分析,试图阐述BCS II类药物溶解度增加与药物渗透性的关系,并评述以上策略中不同新技术的运用及转运蛋白的影响。
以期引起国内研究者的关注,在制剂设计时须同时考虑药物溶解性和渗透性的重要性,为提高口服药物吸收的制剂设计和辅料筛选提供依据。
一、环糊精包合物对渗透性的影响
环糊精是一类具有亲水性表面和疏水性空腔的环状寡糖,具有高度的水溶性,空腔可与疏水性溶质相结合形成包合物而增大溶质的表观溶解度。

通常,药物在胃肠道溶解是口服吸收的先决条件,某些环糊精可与亲脂性药物形成水溶性包合物,从而提高药物的表观溶解度。
然而研究表明,环糊精在提高药物溶解度的同时,常伴随着药物渗透性的降低。
Beig 等发现磺丁基 - β -环糊精 (SEB7 - β - CD,captisol) 对提高难溶性抗心律失常药物胺磺酮的表观溶解度是 2-羟丙基-β-环糊精 (HP-β-CD) 的 10 倍。
原因是除了疏水作用,captisol对胺碘酮的增溶还存在静电作用。captisol 在生理条件下带负电,而胺磺酮在整个消化道pH均带正电。
然而人工PAMPA膜渗透性实验和大鼠肠道灌流实验表明,胺碘酮的表观渗透性均随两种环糊精浓度及药物表观溶解度的升高而降低,并且 captisol降低胺碘酮渗透性的作用较 HP-β-CD 显著。
此外,Fine-Shamir 等提出设计环糊精包合物处方时,环糊精浓度应不超过能增加药物溶解度的最大量,否则过量的环糊精反而会导致BCS II类药物达那唑渗透性下降,从而影响药物的口服吸收。
环糊精与药物相互作用形成结合态的包合物存在脱包合与被包合的微观动态平衡,Carrier 等认为由于环糊精形成的包合物不能渗透通过肠壁,只能通过游离状态溶解的药物发挥口服药效。
环糊精浓度增加到一定程度和形成包合物的结合常数较高时,脱包合与被包合的动态平衡向形成包合物的结合态方向进行,导致动态平衡中脱包合出来的非结合态游离溶解的药物浓度降低,从而间接地降低了药物在胃肠道的渗透吸收。
可见,药物溶解性与渗透性相互联系,共同影响环糊精中药物口服吸收。
Miller 等对环糊精包合物中药物溶解性-渗透性的相关性建立了数学模型,试图阐明环糊精对药物通过肠道静流层 (unstirred water layer,UWL) 的渗透系数 (Paq) 和肠膜渗透系数 (Pm) 的影响,并用于预测有效渗透系数 (Peff) 和环糊精浓度(cyclodextrin concentration,CCD) 的相关性。
该模型提出,亲脂性药物通过肠道吸收进入血液循环需要依次渗透通过 UWL 和肠道上皮细胞膜,其中 UWL 的厚度随着 CCD 的增加迅速降低,而Paq显著增加。Miller等推导的公式:
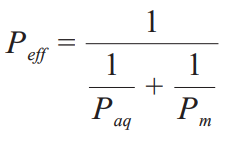
由公式可知,Paq增大会使其对 Peff影响减小,故CCD高于一定浓度后,UWL 被环糊精有效消除。
亲脂性药物中Paq是吸收限速步骤,当环糊精的浓度达到一 定程度能消除UWL的影响,使Paq变成无关参数,由于只有脱包合中游离状态溶解的药物才被纳入渗透性判断,此时游离态药物的 Peff≈Pm,Peff变化取决于药物跨肠道上皮细胞膜的效率。
如上所述,较高浓度的环糊精包合会导致游离态溶解药物的浓度下降,进而使Pm 减小,并最终导致药物Peff下降。
二、表面活性剂增溶对药物渗透性影响
具有亲水亲油两亲性的表面活性剂,当其浓度超过临界胶束浓度时,难溶性药物被包裹在表面活性剂胶束的亲脂性栅栏中,可提高药物的表观溶解度,广泛应用于亲脂性药物口服递送系统。

近期有研究发现,表面活性剂在增加难溶性药物表观溶解度的同时,BCS II类药物的渗透性与环糊精相似,也呈现下降趋势。
Miller等通过改变表面活性剂十二烷基磺酸钠 (SLS) 和牛磺胆酸钠 (STC) 的浓度,研究胶束增溶对黄体酮 Pm和 Paq的影响,以预测整体 Peff值。
经大鼠空肠灌注实验,游离黄体酮表现出高渗透性,而在SLS和 STC 高于临界胶束浓度黄体酮被增溶后,随着表面活性剂浓度升高,黄体酮Peff显著降低。提示表面活性剂达到临界胶束浓度后,提高药物表观溶解度以降低渗透性为代价。
与环糊精增加溶解度类似,表面活性剂形成胶束后将亲脂性药物增溶在胶束内部存在结合态与非结合态的微观载药动力学平衡,当表面活性剂浓度增加导致体系中游离状态溶解的药物浓度相对下降,而胶束难渗透通过胃肠道,此时胃肠通透性主要由游离态溶解的药物浓度决定,从而导致药物渗透性下降。
因此,不难理解为何表面活性剂对 BCS II类药物的溶解性和渗透性影响显著。
表面活性剂提高其他类型药物 (如 BCS III、BCS IV类药物) 口服吸收,则可能与其破坏生物膜的完整性、增加细胞旁路转运等因素有关 。
近期 Beig 等发现,维生素 E 聚乙二醇琥珀酸酯 (vitamin E - TPGS,TPGS) 增溶依托泊苷中,随着 TPGS 浓度提高,依托泊苷在平行人工渗透膜 (PAMPA) 的渗透率显著下降,而在大鼠肠灌流的渗透率却增加,这可能是由于 TPGS 能抑制体内 p-糖蛋白 (P-gp) 表达,减少药物外排从而总体上提高了药物的渗透性。
因此,为了实现口服吸收的最大化,除了同时考虑表面活性剂胶束对药物的溶解性和渗透性的影响,还要关注其他体内复杂因素的影响,并以体内实验结果为准。
三、潜溶剂对溶解度与渗透性的影响
游离状态溶解的药物在肠膜两侧的浓度梯度是药物跨膜渗透的驱动力,上文所述的两种增加药物溶解度方法——环糊精和表面活性剂,增加药物表观溶解度会导致体系中非结合态溶解药物的浓度降低,从而降低药物渗透性,该现象似乎在BCS II类药物中广泛存在。
当其他增加药物溶解度的手段中不存在载体与药物相互作用形成结合态的关系,溶解的药物仅以单分子 (离子) 状态分散于溶剂中,BCS II类药物是否还出现增加溶解度而降低药物渗透性的现象?
潜溶剂 (cosolvent) 则能解决这一问题用于该现象的研究。
为了提高难溶性药物的溶解度,常使用两种或多种混合溶剂,当混合溶剂中各溶剂达到一定比例时,药物的溶解度出现最大值,这种溶剂被称为潜溶剂。
潜溶剂具有氢键供体和/或受体以及小的烃区,其中亲水氢键基团保证了与水的相容性,疏水烃区则可以干扰水的氢键网络,通过破坏水的自缔合,潜溶剂降低水排斥疏水化合物的能力,从而增加亲脂药物的溶解性,不存在载体与药物相互作用形成结合态与非结合态的关系,溶解的药物均以单分子 (离子) 状态分散于溶剂中。
然而研究表明潜溶剂在增加药物溶解度的同时药物渗透性也存在下降趋势。

Riad 和 Beig 等使用动物肠灌注实验分析 PEG 400 对卡马西平肠渗透性的影响,发现随着 PEG 400 比例增加,药物渗透性呈现降低趋势。
类似地,Beig 等比较了 20%、60% 和 100% PEG 400 对卡马西平溶解性和渗透性的影响。发现 100% PEG 400 增加溶解度能力最强,20% PEG 最弱,而药物渗透性作用则相反。
口服生物利用度从高向低排列为 60% PEG 400 > 100% PEG 400 > 20% PEG 400。提示 PEG 400提高口服生物利用度是药物溶解性和渗透性的综合效应。
Miller等研究不同浓度 PEG 400 和丙二醇对黄体酮的溶解性和大鼠肠道渗透性的影响,并使所有潜溶剂保持在等效的热力学活性水平,仍出现了类似药物表观溶解度增加而渗透性下降的规律;同时通过建立数学模型试图阐述潜溶剂中 BCS II类药物溶解度增加而渗透性下降的现象。
发现不同于环糊精和表面活性剂载体浓度增加而降低游离状态所溶解的药物含量,潜溶剂浓度增加导致亲脂性药物的表观溶解度增加,而降低药物的表观膜/水分配系数,由药物跨膜渗透系数公式分析,药物跨膜渗透的热力学驱动力下降,从而降低药物的渗透性。
因此,通过分析环糊精、表面活性剂和潜溶剂中BCS II类药物的溶解性与渗透性,认为能够影响溶解药物的游离态含量或改变药物表观膜/水分配系数的制剂手段,必然会改变BCS II类药物的渗透性,当该理论应用于体内时必须结合体内复杂环境进行综合判断。
四、无定形固体分散体对药物溶解性-渗透性的影响
与前述溶解性-渗透性内在关联的规律不同,无定形固体分散体通过维持药物的过饱和状态来增加其溶解度,则较少出现药物渗透性降低的情况。
无定形固体分散体中药物溶解性与渗透性的这种相关性可以用前述的药物跨膜渗透方程解释。
1、无定形固体分散体中药物溶解性-渗透性的相关性
有文献发现,与对照组 (结晶药物) 相比,无定形固体分散体中药物的过饱和度平均能够达到其特性溶解度的28.2倍,渗透性则平均增加2.39倍。
用喷雾干燥法制备 BCS II类药物硝苯地平的无定形固体分散体,其药物过饱和度可以达到平衡溶解度的 20 倍。
通过研究不同程度过饱和溶液中硝苯地平在PAMPA和大鼠小肠单向灌流中的渗透,发现溶解度的增加并没有降低药物渗透性。对黄体酮无定形固体分散体的研究也呈现类似结果。
Beig等比较了HP-β-CD、PEG 400-水潜溶剂体系、表面活性剂SDS 及PVP无定形固体分散体4种增加溶解度的方法对抗癌药依托泊苷溶解度和渗透性的影响。发现使用环糊 精、表面活性剂和潜溶剂增加药物表观溶解度时会导致药物的渗透性降低,而将药物制备成无定形固体分散体则不会。
由此可见,无定形固体分散体对药物溶解性-渗透性的影响与以上其他几种增加溶解度的方法不同,其机制可以用药物跨膜渗透系数方程解释。
简而言之,药物的渗透性受到药物膜/水分配系数的影响,而膜/水分配系数又由药物的溶解性决定,无定形固体分散体是通过非平衡动力学的途径增加药物溶解性,对药物的膜/水分配系数没有影响。因此,药物的渗透率不变且与药物的过饱和程度无关。
2、添加聚合物辅料对无定形固体分散体的影响
固体分散体虽然能显著增加难溶性药物溶解性,但容易老化,即物理稳定性差是其应用的缺点之一。近年来,诸多研究在固体分散体中添加适宜的聚合物,有助于维持药物的无定形状态。
聚合物的加入是否影响无定形固体分散体溶解性-渗透性原有的特性?
Fan 等在用 Eudragit 100 制备的姜黄素无定形固体分散体中添加羟丙基甲基纤维素 E5 (HPMC E5),发现 HPMC E5能够抑制药物结晶维持无定形状态,同时降低磷脂双分子层的有序度,从而改善药物渗透性。
但也有研究表明,使用树枝状生物聚合物 (dendrimer-like biopolymers,DLB) 制备无定形固体分散体时,由于聚合物和药物分子可以发生分子相互作用,在水中形成稳定的药物-聚合物系统通过影响药物释放从而降低口服吸收 。
Fülöp 等通过分别添加不同类型聚合物 PEG 6000、月桂酸酯 D-1216、棕榈酸酯 P-1670和硬脂酸酯 S-1670 成功增加 BCS II类药物甲芬那酸的溶解度,但 Caco-2 细胞渗透转运实验表明,这些聚合物的添加并没有显著改变药物渗透性。
由此可见,聚合物辅料的添加使得无定形固体分散体体系变得复杂,此时药物的溶解性和渗透性变化需要依据药物的理化性质和所添加的物质综合判断。只有选择适宜的聚合物辅料才能同时增加无定形固体分散体中药物溶解性和渗透性,更有效地提高口服吸收。
五、其他过饱和药物递送系统
任何过饱和药物递送系统(supersaturating drug delivery systems,SDDS)都可能具有无定形固体分散体这样的特点,即提高溶解度同时不降低药物渗透性。因此SDDS制剂将作为提高口服吸收的有效手段。
SDDS 中研究最多的是无定形固体分散体 (44.9%),其次是超饱和脂质配方(22.2%)、纳米药物系统 (12.4%)、二氧化硅药物系统 (6.5%) 和其他 (11.3%)。
通过对前 4 种 SDDS 进行 Meta 分析,发现与药物结晶相比,制剂的最大过饱和度通常可以达到药物特性溶解度的 26.7 倍;体外 (包括人工膜,透析膜,Caco-2 细胞和 MDCK 细胞模型实验) 和体内实验数据 (大鼠肠灌流实验) 中SDDS能使药物的总渗透性 增加3.1倍。
其中,纳米给药系统的体外过饱和度和体内生物利用度 (AUC 和 Cmax) 提高最明显,Tmax降低最显著。
Li等研究发现,BCS II类药物醋酸甲地孕酮的纳米乳与其微晶混悬剂相比,在比格犬中的口服生物利用度提高5倍。
纳米药物系统的最大优势是粒径减小,能够使药物的渗透性提高至原本的3.09倍,其产生过饱和的能力主要是由于纳米晶体表面的曲率增加、晶体棱边的比例增加及边界扩散层的厚度减小,同时部分药物非晶化。
以上结果均提示,SDDS的过饱和特征能够同时提高药物溶解性-渗透性,即在增加药物溶解度的同时,不会降低甚至提高其渗透性。
六、转运蛋白对药物溶解性-渗透性的影响
BCS II类药物主要通过被动扩散进入细胞,然而外排转运蛋白如 P-gp 参与亲脂性药物的胃肠道渗透过程则会极大地影响药物的渗透。
大量研究表明,使药物处于过饱状态和/或抑制转运蛋白可增加 BCS II类药物在胃肠道中的渗透性。
利福昔明是由利福霉素改良的抗生素衍生物,为 BCS Ⅳ类药物具有低溶解度和低渗透性,广泛用于治疗胃肠道细菌感染。除了受限于溶解度,利福昔明渗透性受到 P-gp 介导的外排转运影响。
Beig 等设计了一种高过饱和水平的利福昔明无定形固体分散体。当药物的过饱和水平为特性溶解度的 100 倍时,利福昔明在大鼠体内的肠道渗透性保持不变;当药物的过饱和水平为特性溶解度的 250 倍时,药物的肠道渗透性显著增加。然而药物在 PAMPA 上的渗透性始终保持不变。
这提示,当药物是 P-gp 的底物时,无定形固体分散体可以通过饱和外排转运蛋白 P-gp 增加药物渗透性。
Beig 等发现维生素 E 聚乙二醇琥珀酸酯 (TPGS) 能抑制体内p-糖蛋白 (P-gp) 表达,减少药物外排,随着 TPGS 浓度提高依托泊苷溶解度增加同时在大鼠肠道灌流的渗透率也显著增加。
值得注意的是,对于非 P-gp 作用底物的药物,加入具有外排转运体抑制作用的聚合物,也能获得类似结果。
利伐沙斑是一种口服活性丝氨酸蛋白酶因子 Xa 抑制剂,用于治疗静脉血栓栓塞症,被认为是 P-gp 的不饱和底物,极大限制它的渗透性。
Mohammadzadeh 等研究使用Eudragit S100、Eudragit L100和Soluplus 制备利伐沙斑的无定形固体分散体,结果显示Soluplus 制备的利伐沙斑无定形固体分散体的表观溶解度比利伐沙斑晶体增加了 10 倍。
Caco -2 转运实验表明,Eudragit S100所制备的无定形固体分散体的外排率比利伐沙斑晶体显著降低了约 66.7%,而 Eudragit L100 组没有显著变化。
因此推测 Eudragit S100 具有降低 P-gp表达的能力,对P-gp底物的外排过程有抑制作用而增强药物渗透性。
Soluplus制备的无定形固体分散体的外排率下降,但 Soluplus 不影响底物与 P-gp 的结合,也不改变细胞膜上P-gp的表达,说明Soluplus是通过与 P-gp 发生间接相互作用和改变细胞膜的流动性来实现对 P-gp 的抑制从而提高药物在胃肠道的渗透性。
综上,使用适宜的辅料制备无定形固体分散体可以增加药物溶解性又抑制 P-gp活性,从而提高药物口服吸收生物利用度。
七、新型药物溶解性与渗透性评价方法
随着分析和微型化技术的发展,药物吸收筛选模型在药物研究中的应用迅速发展起来,从生物膜转运器细胞模型如 Caco-2细胞、到体外吸收实验如 Ussing chamber 扩散池及在体动物实验如小肠单向灌流等。
目前已建立许多新型药物吸收评价模型,具有同步评价药物溶解性和渗透性的优势,便于筛选药物口服吸收最佳处方。
Fong等提出一种新型的微透析-溶出/渗透系统[microdialysis-dissolution/permeation (M-D/P) system],将微透析单元固定在溶出池中,仿生膜 Permeapad?作为肠道吸收屏障固定于接收室,能够同时评价药物的溶解与渗透行为,具有对渗透过程干扰小、节省时间和采样时间准确的优势。
Ruponen 等利用 PAMPA 固定于特殊的扩散池中,同时测定格列本脲与丝氨酸或精氨酸共晶体系中药物的溶解和渗透性,建立了一个简单易得用于筛选无定形制剂的工具。
不同于细胞或组织上的渗透实验,Berben等发明了一种高效又经济的人工膜嵌入系统 (artificial membrane insert system,AMI-system),结合溶出实验用于初步评价制 剂口服吸收效果。
实验表明,AMI-system能很好地预测3种难溶性药物的溶解性和渗透性,包括pH变化对混悬剂中泊沙康唑吸收的影响;肠道稀释对环糊精包合物中伊曲康唑吸收的影响;食物摄取对非诺贝特吸收的影响。
因此,合理选择新型药物吸收评价手段,能 够同步评价药物溶解性与渗透性,便于研究者筛选口服吸收的最佳处方。
结 语
提高BCS II类药物口服吸收,对于临床应用具有十分重要的意义。
传统的制剂设计主要聚焦于提高药物溶解性,而忽略了其对胃肠道渗透性的影响,从而弱化了制剂策略对药物口服吸收的总效应。
提高药物表观溶解度的不同策略如环糊精包合物、表面活性剂载体、潜溶剂、无定形固体分散体和其他过饱和药物递送系统对渗透性的影响不同。
药物形成环糊精包合物或被表面活性剂增溶,由于体系中游离状态溶解的药物浓度降低,使得药物在胃肠道渗透性下降;潜溶剂通过降低水排斥疏水化合物的能力增加药物表观溶解度,而降低药物膜/水分配系数导致渗透性下降;无定形固体分散体和其他过饱和药物递送系统能在有效提高药物溶解度的同时,不改变甚至增加其药物渗透性,但仍 需针对具体药物选择适宜的辅料控制过饱和程度。
此外,外排转运蛋白 (P-gp) 在体内胃肠道转运中发挥重要作用,使药物处于过饱和状态和/或抑制转运蛋白可以增加BCS II类药物在胃肠道中的渗透性,同时利用新型技术手段能够更好模拟体内药物溶解与渗透行为,筛选最佳口服吸收处方。
综上,药学工作者在进行制剂设计时应周密考虑不同剂型中药物溶解性和渗透性的影响,深入了解不同制剂策略中药物的溶解与渗透性相关性,并结合体内复杂因素才能更好地制定提高口服吸收最佳处方,提高制剂设计的合理性与规范性。
来源:《药学学报》
原标题:《通过增加溶解度提高BCS II类药物口服吸收:常常被忽略的药物渗透性》
作者:章溢,崔天,李姝璇,饶义琴,胡海燕
声明:药研江湖对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)







