前面的文章中,小编已经大致的介绍了一些有关于环糊精包合物的知识,包括环糊精的结构、环糊精的增溶机制等。
今天我们就接着前面的文章,进一步来学习一下环糊精包合物在药物增溶中的作用以及该技术在药物研发中的实际应用案例。
环糊精是一种用途广泛的功能性辅料,可以通过与难溶性药物的相互作用,增加后者的溶解度,并提高生物利用度。
由于环糊精可以提高难溶性药物溶解度,并且能够提高药物稳定性,目前已经有很多款基于环糊精的药物上市。
环糊精的化学结构及性质
环糊精是来源于淀粉的环状寡糖,含有六个(αCD)、七个(βCD)、八个(γCD)、九个(δCD)、十个(εCD)或更多(α-1,4)-连接的α-D-吡喃葡萄糖单元。
如果我们单纯从天然的环糊精含有的基团来看,或许会认为天然的环糊精会具有较高的溶解度,因为天然的环糊精外表面具有较多的羟基。
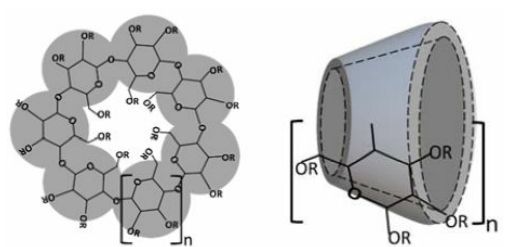
但是实际上天然的环糊精溶解度很差,这是由晶格中相对较强的分子内氢键造成的。
天然环糊精任何形成氢键的羟基被取代,即使是被亲脂性基团取代,都可以导致其水溶性的显著提高,基于这种情况,目前开发出许多环糊精的衍生物,如α-环糊精、β-环糊精、γ-环糊精、2-羟丙基-β-环糊精、磺丁基醚-β-环糊精等。
由于葡萄糖单元的椅子构象,环糊精的形状像一个截短的锥体,羟基朝向外部,由于这种构象,环糊精含有亲脂性中心空腔和亲水性外表面,它们中央腔的微环境是相对非极性和亲脂性的。
目前应用的大部分环糊精衍生物都是由β-环糊精合成的。合适的化学修饰可形成无定形的或部分结晶的环糊精衍生物,其具有高水溶性,并且能显著降低对胃肠道的毒性,这是由取代基团所决定的。目前最受关注的环糊精衍生物为羟丙基-β-环糊精(HP-β-CD)以及磺丁基醚-β-环糊精(SBE-β-CD)。
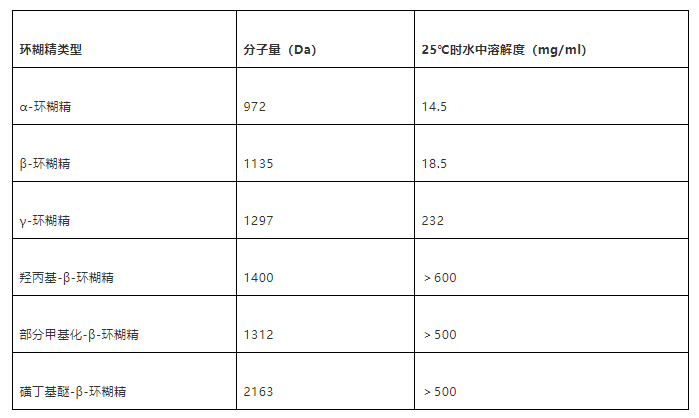
表1 各环糊精分子量及溶解度
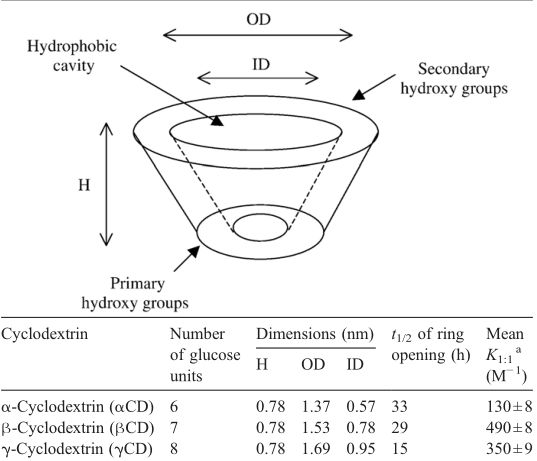
图1 天然α-环糊精、β-环糊精、γ-环糊精性质
环糊精毒理学
环糊精分子量从1000~2000道尔顿不等,并且是亲水的,含有大量的氢供体和受体,因此不能以完整的形式被胃肠道吸收。
天然的γ-环糊精可以被唾液和胰腺淀粉酶水解,α-环糊精与β-环糊精不可以被唾液和胰腺淀粉酶水解,但是α-环糊精与β-环糊精可以被肠道菌群发酵。
α-环糊精可用于注射液以及片剂中,一般来说,口服α-环糊精耐受性良好,一般不会产生明显的副作用。α-环糊精只有很小的一部分被胃肠道吸收,大部分以原形从尿液中排除。
β-环糊精可用于口服给药、口腔给药以及直肠给药。由于β-环糊精的水溶性较差,并且具有一定的不良反应,如肾毒性,不能通过非胃肠道形式给药,但是β-环糊精口服是无毒的,所以一般都用于口服给药。
γ-环糊精的代谢与淀粉比较类似,口服后仅仅非常少量的γ-环糊精从胃肠道中被完整吸收,而静脉注射后大部分以原形从尿液中排除。
亲水性环糊精有羟丙基-β-环糊精(HP-β-CD)以及磺丁基醚-β-环糊精(SBE-β-CD),在低至中等口服剂量和静脉注射下被认为是无毒性的。相比于β-环糊精,羟丙基-β-环糊精水溶性更好、毒性更低。目前羟丙基-β-环糊精已经被证明在人体中耐受性良好,主要的不良反应就是腹泻的发生率增加。
环糊精提高药物溶解度方法
每种用于改善药物溶解度的技术都有其优点和缺点。其中,络合技术被更精确地用于改善水溶性差的药物的溶解度和溶出度。
络合通常被定义为底物和配体形成新的可逆的复合物。根据化学键的类型,络合物通常可以分为两类,即配位络合物和分子络合物。
配位络合物是由配位键形成的,在配位键中,一对电子在某种程度上从一个界面转移到另一个界面。例如,一般金属离子与碱之间形成金属离子配位络合物。
分子络合物是由底物和配体之间的非共价相互作用形成的。这一类包括小分子-小分子复合物、小分子-大分子物种、二聚体以及包合物等。
本篇文章重点介绍一下环糊精包合物在改善药物溶解度方面的潜力。
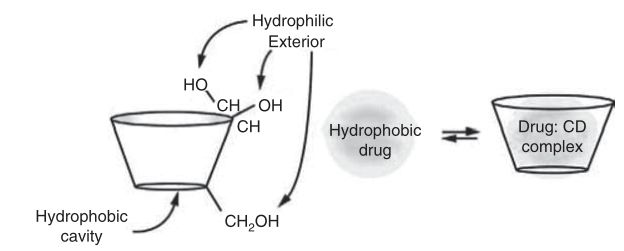
图2 药物在环糊精疏水腔内的络合作用
什么条件下可以使用环糊精包合技术
为了提高速释口服剂型药物的溶解度和溶出度,我们可选择多种技术进行药物增溶,那么什么条件下我们可以选择环糊精包合技术呢?
当满足以下两点要求时,我们可以考虑使用环糊精络合技术进行药物的增溶。
(1)包合物在胃肠道中溶出速率不受限
第一点药物就是药物-环糊精包合物在胃肠道中的水溶性必须是足够的,防止药物-环糊精包合物在胃肠道中的溶出速率受限。
因此,对于水溶性小于0.1~0.05mg/ml的药物,我们可以选择该方法进行增溶。因为根据BCS分类规定,速释口服剂型的最大剂量与溶解度比必须低于约250毫升(因为人体内胃液肠液总体积大约为250毫升),水溶性大于0.1~0.05 mg/ml的药物在口服后一般不会表现出溶出速率限制药物的吸收这样的问题。
因此,Ⅱ类(低溶解度-高渗透性)和Ⅳ类(低溶解度-低渗透性)药物最适合用环糊精包合的方法提高药物溶解度。
环糊精包合技术一般只适用于高效力的药物,因为如果药物的效力过低,那么药物的剂量就会较大,再加上环糊精以及其余的辅料,就会导致整个的口服片剂重量过大,不利于病人的吞服。
对药物的选择要求
(1)药物的熔点应该在250℃以下,否则药物分子间的内聚力太强。
(2)药物分子组成应小于5个稠环(芳香环的一种,两个环共用两个碳原子),否则可能太大。
(3)极性应该小于水的极性。
(4)其分子量应在100~400之间,如果药物分子量很小,则复合物的药物含量太低。但是如果药物分子过大,药物和环糊精则可能不适合1:1的比例,因此可能需要1:2、1:3等比例。
药物与环糊精包合物的形成很大程度上取决于化合物的尺寸与环糊精空腔的尺寸的相容性。然而,包合物的稳定性也取决于药物分子的其他性质,如极性。
由于很多药物通常是大分子,因此通常观察到包合物只有药物某些基团或侧链渗入碳水化合物通道中,并没有完全进入中心空腔。
当药物分子太大而无法在一个空腔中找到完全的容纳空间时,就可能形成1:2包合物。
包合物的稳定性与取代基的疏水性成正比,因此,甲基或乙基取代基将增加稳定性。
制备环糊精包合物的方法
制备环糊精包合物具有以下几种方法,络合效率取决于形成的络合物的性质和制备方法。
(1)溶剂挥发法
该方法将药物和环糊精溶解在共同的溶剂中,在真空条件下将溶剂挥发,从而得到药物-环糊精包合物固体粉末。
(2)物理混合法
物理混合法就是将药物与环糊精通过机械研磨的方法将两者混合到一起,然后根据自己的需要,过一定数目的筛子。实验室规模可在研钵中进行制备,在大生产中,一般通过制粒机将药物与环糊精混合物进行混合压制,从而得到包合物。
(3)捏合法
捏合法就是先用少量的水或乙醇将环糊精制备成糊状,然后将药物加入到糊状物中,揉捏一定的时间。然后将捏合物烘干,烘干后根据自己的需求对其过筛处理。实验室的捏合可利用研钵和杵来完成,大规模的捏合需要使用挤出机等大型仪器。
(4)共沉淀技术
共沉淀技术中,一般需要先制备环糊精饱和水溶液,然后将药物加入溶液中,磁力搅拌,随后会有沉淀物析出,形成的沉淀物通过真空过滤分离,并在室温下干燥,即得到包合物。
对于水溶性的药物,可直接投药,而对于难溶性药物,一般先将药物溶解在少量的介质中,然后才进行投料。
该方法由于产率低,并且使用有机试剂风险大,所以大生产中很少使用。
(5)研磨法
通过机械对药物和环糊精混合物进行研磨,可以制备二元的环糊精包合物。
(6)喷雾干燥法
在制药行业中,喷雾干燥是一种从液相中获得干粉的常用技术。
该方法中,药物-环糊精混合物溶液被雾化,然后产生的喷雾进入热空气,从而得到干燥的环糊精包合物。
该技术在形成络合物方面具有很高的效率。此外,用这种方法得到的产品具有更均匀的大小和多孔的颗粒,从而进一步提高了药物的溶解度。
(7)冷冻干燥法
通过冷冻干燥技术,可获得多孔的、外形疏松的包合物粉末,使用该方法制备的环糊精包合物溶解性较好。
该技术一般先将药物-环糊精溶液在-30至-40℃下预冻,然后减压,通过升华将其干燥,从而获得环糊精包合物粉末。
使用冷冻干燥法可以成功将不耐热药物与环糊精制成包合物,但是该技术的局限性在于它耗时较长,而且获得的产品流动性较差。
环糊精包合物的鉴定
(1)差示扫描量热法
差示扫描量热法(DSC)目前经常用来鉴定包合物常用的技术。
药物的熔点通常由于络合作用而发生改变,所以当形成环糊精包合物时,包合物熔点相对于药物可能会发生一定的变化,或者由于无定形而没有熔点。
在DSC中,相互作用表现包括吸热峰的消失、新峰的出现以及峰位置的变化等。
(2)X射线衍射法
X射线衍射也是鉴定包合物常用的技术。
原理是各晶体物质在相同的角度具有不同的晶面间距,从而显示了不同的衍射峰。所以,若是所制备的粉末出现了药物和环糊精原本没有的衍射峰,就证明形成了药物-环糊精包合物。
环糊精包合物的优势
随着环糊精络合技术的发展与使用,几乎每种剂型都有可能通过环糊精包合技术进行一定的改良。
环糊精包合物已被证明可以改善一些途径给药的生物利用度,如眼部、外用、鼻腔和直肠途径。
环糊精络合物对提高Ⅱ类及IV类药物的溶解度和稳定性还具有一定的作用,如在格列本脲、格列美脲、尼美舒利等药物中就使用了环糊精包合技术,从而提高了药物溶解度或稳定性。
环糊精包合物能够提高药物的生物利用度,主要是由于提高了药物的溶出度和溶出速率。
除了上述所说的优势外,环糊精包合物也可能改变药物吸收部位的脂质屏障,从而增强药物的吸收。
环糊精包合物对脂质屏障的这种作用可以归因于环糊精包合物与细胞膜的成分(如胆固醇、磷脂酰胆碱和蛋白质)形成复合物,从而改变了脂质屏障。
环糊精包合物的另一个优势就是通过包合作用改善了药物的化学稳定性,一些药物包合后,药物的氧化、光解以及水解等反应明显减弱。
(1)固体制剂中的优势
环糊精包合物能通过提高难溶性药物的溶解度或溶出度,改善其口服制剂的生物利用度;通过抑制或阻止晶体生长,可以提高亚稳态晶型或无定形药物的物理稳定性;通过提高分散性和流动性,可以保证即使少量的药物也可以在制剂中分布均匀;由于稳定性提高,可以延长药物的货架期。
(2)液体制剂
可以改善药物在水中的溶解度或稳定性。
(3)混悬剂和乳剂
可以提高分散系统的物理稳定性,环糊精包合物的保护层可以抑制混悬剂和乳剂的相变。
(4)半固体制剂
通过促进药物从软膏或栓剂中的释放来提高药物的生物利用度;亲水性环糊精包合物可以提高油性基质及油包水型基质的吸水能力。
(5)注射制剂
可以提高药物在水中的溶解度或稳定性;可以减少药物引起的溶血和肌肉组织损伤。
环糊精包合物的局限性
环糊精包合物虽然具有很多优点,但同时也有一些缺点限制了该技术的使用。
首先,药物与环糊精必须能够形成络合物,对于溶解度非常有限的药物来说,溶解度提高以后可能还是非常有限的。
第二个限制是,对于一些环糊精络合物,体系的稀释可能导致沉淀产生。
第三,环糊精与药物可能存在潜在的毒性问题,可能会增加产品开发过程的复杂性和成本。
最后,络合效率往往比较低,因此通常需要相对大量的环糊精才能达到理想的增溶效果。
环糊精包合技术也是目前主要的药物增溶技术之一,当遇到难溶性药物时,可思考一下,我们的药物是否可以通过环糊精包合物技术提高溶解度。
以上为小编自行整理的一些内容,希望对大家有所帮助。
声明:铭研医药对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)







