药物制剂的各剂量单位中,活性药物成分的含量可能因制剂生产中的多种原因,如颗粒的流动性及均匀性较差、生产设备的性能未达到要求等,使固体制剂、半固体制剂和非均相液体制剂的一批产品之间存在或多或少的差异,从而影响药物制剂的疗效。

而且,绝大多数的药物制剂在制备过程中都包括将各种原辅料混合均匀的工艺过程,由于这个工艺过程的不稳定或不完善,可能引起批产品中的每个产品含量差别较大。特别是当一个单剂中主成分或复方制剂中某个主成分绝对量较小或主成分在整个处方中所占比重较小时,主成分很难与其他成分及辅料混合均匀,从而导致批产品的不均匀。
因此,需要控制药物制剂的剂量单位均匀度(uniformity of dosage units),即多个剂量单位中所含活性药物成分的均匀程度。
中国药典、美国药典、欧洲药典对于剂量单位均匀度的表示方式是有差异的,中国药典的检查项目为重量差异、装量差异、含量均匀度,美国药典是重量差异(weight variation)和含量均匀度(content uniformity),而欧洲药典在美国药典的基础上还有两个检查项目---uniformity of content 和 uiformity of mass。
如此相似的检查项目,如何区分?如何使用?如何计算?
今天小编就对三家药典的剂量单位均匀度要求进行详细解读。

一、中国药典
1.1 总论
下表是对药典通则中,常用的几种剂型的总结。可以看出,中国药典对剂量单位均匀度的要求包括装量、最低装量、装量差异、重量差异、含量均匀度。
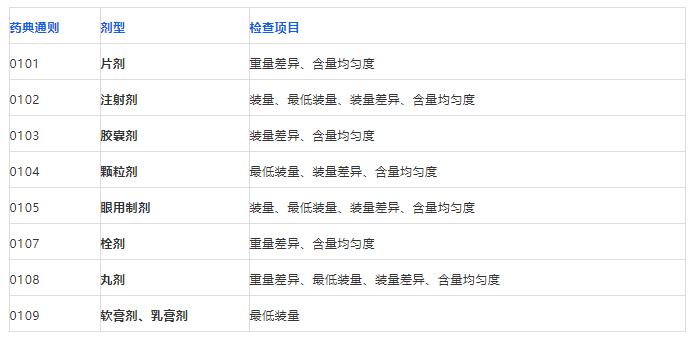
各项检查项目的依据及相关剂型见下表:

需要注意以下几点:
装量和最低装量的不同!
糖衣片的片芯应检查重量差异并符合规定,包糖衣后不再检查重量差异。
薄膜衣片应在包薄膜衣后检查重量差异并符合规定。
凡进行含量均匀度检查的制剂,不再进行重量/装量差异检查。
装量、最低装量、装量差异、重量差异的检查方法较为简单,查阅好药典中相关的限度要求,按要求操作即可。
本文重点介绍含量均匀度的检查方法和判定方法。
1.2 含量均匀度
检查法:取供试品10个,按各品种项下规定的方法,分别测定每一个单剂以标示量为100的相对含量x1、x2、、、、x10,10个含量结果的均值为x?,用Excel算出标准差S,标示量100与x?差值的绝对值为A。
判断标准:

初试10个、复试20个,一共30个含量结果的判定方法:

(注:除另有规定,L=15.0;单剂量包装的口服混悬液、内充非均相溶液的软胶囊、胶囊型或泡囊型粉雾剂、单剂量包装的眼用、耳用、鼻用混悬剂、固体或半固体制剂L= 20.0;透皮贴剂、栓剂L= 25.0)

二、美国药典
2.1 总论
美国药典的剂量均匀度相对简单,只有<905 uniformitu of dosage units>,包括content uniformity(CU)和weight variation(WV)。
二者的选择依据见下表:
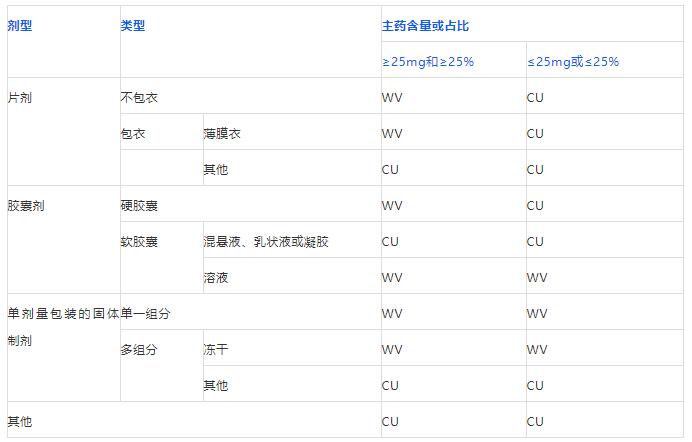
那么,问题来了:糖衣片应该做哪项检验?
小伙伴惊呆了没有?
2.2 content uniformity(CU)
检查法:取供试品10个,按各品种项下规定的方法,分别测定每一个单剂以标示量为100的相对含量x1、x2、、、、x10,10个含量结果的均值为x?,用Excel算出标准差S。
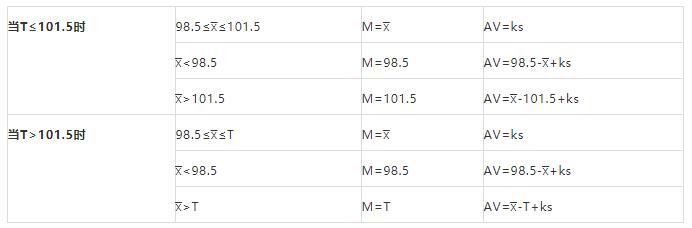
计算公式:AV=|M-x?|+ks
其中,k=2.4;T为目标含量,与生产投料量有关,根据T值不同,计算M和AV,见下表,从而计算出AV值。判定标准见2.4。
2.3 weight variation(WV)
检查法:取供试品10个,分别称取重量w1、w2、、、、w10,含量x1=w1*A/W#,其中A为含量测定项下的含量值,W#为平均重量,同样计算x2、x3、、、、x10。
计算公式:AV=|M-x?|+ks。
公式及各字母代表含义与2.2相同。
注意:WV和CU虽然计算有些差异,但是判定标准是相同的!!均见2.4。
2.4 判定标准

三、欧洲药典
3.1 总论
欧洲药典这部分比较复杂,包括四个概念,除了与USP一致的CV和WV,还多出了UM和UC。
是不是有点乱?稍待我慢慢捋清楚。
依据和适用范围总结见下表:
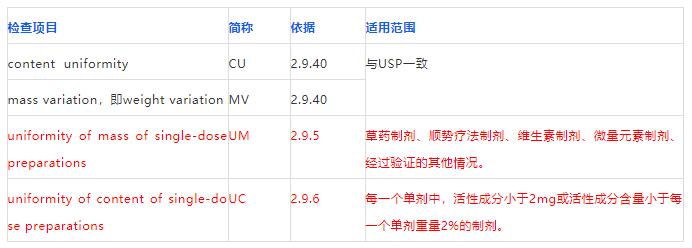
CU和MV与第二部分美国药典一致,第三部分重点说说另类的UM和UC。
3.2 uniformity of mass(UM)
3.1部分列出了UM的适用范围,限度标准也是与中国药典有很大差异的,具体见下表:
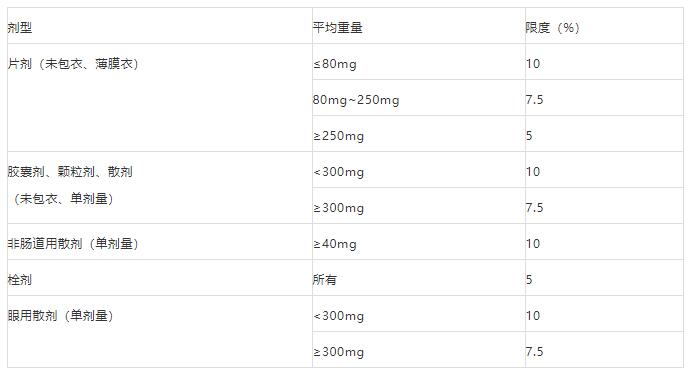
注意:平均重量≤40mg的制剂,需按2.9.6检查。
3.3 uniformity of content(UC)
UC的检查方法与含量均匀度一致,取10个供试品,按各品种项下规定的方法,分别测定含量。
但是判定标准有三种:A、B、C,分别列举了相关剂型,具体要求见下表:

注意!这部分要求是欧洲药典所特有的!
四、总结
看到这里,大家是不是对三家药典的差异感到很很无语、希望ICH多多协调?
大家是否还记得,欧洲药典对活性成分小于2mg或活性成分含量小于每一个单剂重量2%的制剂,应该怎么做?
再多谈谈剂量单位均匀度操作过程的几个要点和注意事项:
1、含量均匀度检查法适用于单剂量包装的制剂,而且药品应有明确的规格,待测成分要有确定的含量上限和含量下限。中药制剂是不适合的!
2、软胶囊含有均相的的内容物,采用装量差异控制,不进行含量均匀度检查。
3、重点说一下单剂量包装的固体制剂,如注射用无菌粉末、冻干制剂、颗粒剂等。
按照中国药典,如果每一个单剂标示量小于25mg或主药含量小于每一个单剂重量25%的,就应该做含量均匀度检查!
但是美国药典和欧洲药典与中国药典的规定不同。
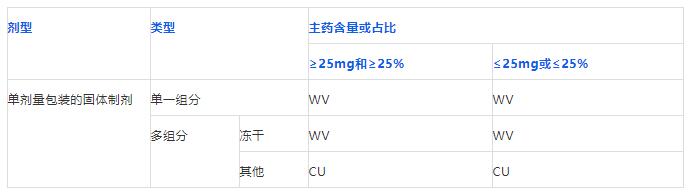
美国药典和欧洲药典将这类制剂划分为单组分制剂和多组分制剂。
注意!组分是包括活性成分和辅料的。
再看一下美国药典和欧洲药典剂量均匀度检查项目分类的表,可以看出,单一组分和冻干制剂是要做装量差异检查的。
4、取样方式需要随机取样,不能采用任何方法进行筛选!
5、含量均匀度测定时间较长时,应注意溶液的稳定性,必要时应随制备随测定。
6、含量均匀度采用紫外-可见分光光度法时,溶剂用量较大时,为避免所用试剂带来的影响,同批号也应该混合均匀后使用,需配制的溶剂应当一次配够。
7、含量均匀度采用高效液相色谱法测定时,如每一针测定时间较长,则应注意保留时间和响应值的漂移,必要时,可在对照品溶液和供试品溶液进样结束后,增加一针对照品溶液回针,来监控系统的稳定性。
三家药典剂量单位均匀度的差异这么大,大家一定要按照各国的质量标准仔细选择方法、判定结论。
牢记,这可是药物制剂的必检项,咱们药圈时刻用得到的,必须弄明白!
小编也是花了很多精力整理,不当之处,欢迎指正,一起进步!
参考文献:
1、中国药典(2020年版)
2、美国药典(43版)
3、欧洲药典(10.0版)
声明:铭研医药对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)







