原标题:《“智能型”药物载体调释新机制研究进展》(《中国新药杂志》2021年第30卷第21期)
作者:范月月,郝文艳,张沙莎,杨阳,高春生(河南大学药学院,军事医学研究院毒物药物研究所,佳木斯大学附属第一医院)
纳米药物设计的主要潜在机制是增强渗透保留(the enhanced permeability and retention effect,EPR)效应,这被认为是药物递送领域的“皇家大门”。
然而,近期的多项研究表明:由于实验室中用于研究EPR效应的模型与人类癌症有很大的不同,纳米药物在临床上几乎不能提高疗效。
因此,研究人员努力在提高EPR效应或减轻抗EPR效应特征方面进行了尝试,发现调节肿瘤异常微环境和刺激响应型纳米药物等多功能纳米药物等改善递送的策略,在增强抗癌药物递送系统方面显示出了有希望的结果。
传统药物递送系统(conventional drug delivery systems,CDDSs)中药物的非特异性分布和不可控释放,促使了“智能型”药物递送系统(smart drug delivery systems,SDDSs)的应运而生。
“智能型”药物载体能够提高药物体内生物利用度、降低毒副作用,受到了广泛关注。
“智能型”药物载体的设计主要围绕着实现2个目标:提高药物对不同组织的靶向性,以及控制药物的释放曲线和释放速率。
这些“智能型”药物载体在常规药物载体如脂质体、胶束、介孔二氧化硅纳米粒子、树状大分子、金纳米粒子、超顺磁性氧化铁纳米粒子、碳纳米管和量子点等基础上,通过附加新的调释机制,能够表现出对外界或内部刺激信号的响应,自身结构/性能发生宏观变化(包括物理状态、形状、溶解度、溶剂相互作用、亲水亲油平衡和导电性等方面的变化),从而以更可控的方式将有效荷载药物释放到特定的部位,以提高治疗效率,减少不良反应,即实现被环境刺激激活,自我调节、综合感知与监测。
根据药物载体响应以发挥预期效果所需的刺激类型不同,本文综述了“智能型”药物载体调释新机制的研究进展以及在药物靶向和缓控释方面的应用。
1、内源刺激响应型
内源刺激响应型药物载体,是指在正常组织和血液中保持载体和药物结构稳定,减轻对正常组织的伤害,可特异性响应病理组织体温高、pH值低、高还原电势、酶浓度不同等生物学差异,靶向病理组织并可控释放药物,提高疗效。
1.1 温度响应型
内源性温度响应型载体是指在生理温度(37℃)附近保持有效载荷,在炎症、恶性肿瘤等病理环境下,病理组织的温度比正常组织高,温度响应型载体能够识别温度的变化并被激活。
温度响应型药物载体通常由热敏聚合物(TSPs)构成,常用的TSPs有聚(N,N-二乙基丙烯酰胺)、聚N-异丙基丙烯酰胺(PNIPAAm)、聚(N-乙烯基烷基酰胺)、聚(N-乙烯基己内酰胺)、普朗尼克、磷腈衍生物、多糖衍生物等。
这类材料,能够在接近体温时表现出温度依赖性和可逆的凝胶膨胀收缩或胶束解体等结构转变,这种转变控制了药物的释放速率,同时保持了物理化学稳定性和生物活性。
PNIPAAm大分子侧链上同时有亲水性酰胺基和疏水性的异丙基,临界溶液温度(LCST)较低(约为32℃),接近体温。
Meisam等制备了一种由有序介孔碳(CMK3)和热敏聚合物PNIPAAm构成的温度响应型智能药物载体,与对照组(不含PNIPPAm)相比,随着温度从4℃升高到37℃,药物释放速率迅速增加超过3倍。
Kim等以脂肪组织中的人α-弹性蛋白为原料,制备了热响应的自组装PEG化的人α-弹性蛋白(the PEGylated human alpha-elastin nanoparticles,PhENPs)。
PhENPs显示出一种热敏相变,在临界温度(32℃)以上迅速形成平均直径330nm的纳米粒子,利用这一特性,只需在水溶液中低温混合,然后加热至生理温度,即可包埋大量的胰岛素[包封率(EE):74.9%]和牛血清白蛋白(EE:60.8%),为可注射蛋白质递送系统中的多种应用提供了机会。
此外,温度响应型药物载体还广泛应用于低细胞毒性抗菌材料的研究。
1.2 pH响应型
传统pH响应型载体主要是基于胃(pH≈2)和肠道(pH≈7)pH的差异,目前靶向实体瘤的pH响应型药物载体得到广泛研究。
由于“Warburg”效应,肿瘤组织和正常组织pH值有很大差异,肿瘤细胞胞外pH值(约为6.0)低于正常细胞胞外pH值(约为7.4),同时,肿瘤细胞内pH值略高于正常细胞,而且肿瘤细胞内各细胞器之间的pH值也有很大悬殊。
因此,pH响应型载体被广泛用于靶向肿瘤药物递送的研究。
pH响应型聚合物常被用来制备药物载体,大致可分为含羧酸基团、磺酸基团的阴离子聚合物和含胺基、吡啶、咪唑基团的阳离子聚合物。
这些pH响应聚合物可以自组装形成各种纳米结构,包括核壳胶束结构、胶束/反胶束、空心微球、囊泡等复杂结构,通过表面活性、链构象、溶解度和构型等结构和性质的变化来响应pH的变化,进而在靶部位控释药物。
此外,还可以在聚合物链或聚合物与药物的连接中引入腙键、酰胺键、缩醛和缩酮键等pH敏感键,通过pH响应的键断裂,促使药物释放。
研究已证实,pH值是一种有效的生理特性,可用于机体病理条件的智能药物递送。
Wang等制备了3种不同交联度的壳聚糖交联聚丙烯酸pH响应水凝胶,发现交联程度和溶液pH值决定了这些水凝胶的溶胀行为和溶胀时间的依赖性,负载水凝胶释放阿莫西林和美洛昔康的速率随着pH值的增加而增加。
此外,一些无机纳米材料(钙纳米粒子、金属氧化物、石墨烯氧化物)和pH敏感肽也被用于研发制备适宜的智能药物载体。
Carole等利用pH响应型单分散二氧化硅微球(mesoporous silicananoparticles,MSNs)作为药物递送载体,成功将抗癌免疫抑制剂R848靶向递送到抗原提呈细胞(antigen presentation cells,APCs)中,有效激活免疫细胞。
这种纳米载体配有生物素-亲和素帽,在环境pH值为5.5及以下时,能够有效刺激释放R848。此外,该MSNs系统能够同时递送模型抗原OVA和佐剂R848,进而可以增强抗原特异性T细胞响应,是一种很有应用前景的癌症疫苗的载体,见图1。
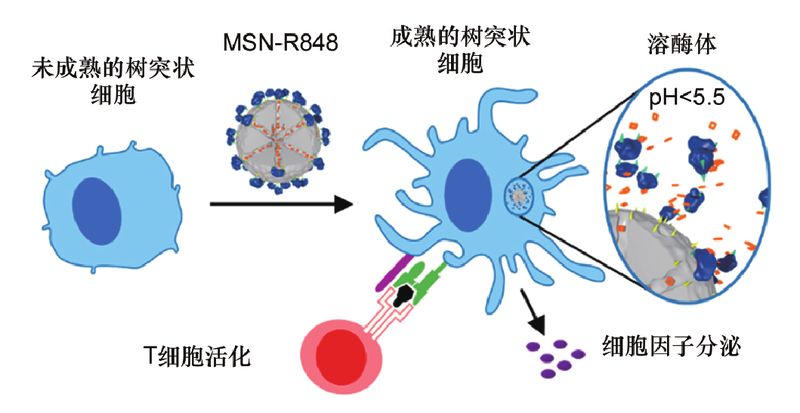
图1 pH响应的介孔二氧化硅纳米颗粒用于递送瑞喹莫德以增强局部免疫应答示意图
1.3 氧化还原响应型
氧化还原响应型载体主要响应的是细胞内谷胱甘肽(glutathione,GSH)依赖系统。
GSH是细胞内的主要还原物质,据报道,GSH在细胞内环境约2~10mmol·L-?,在细胞外基质中约为2~10μmol·L-?,细胞内外GSH浓度相差1000倍以上,这提供了一种细胞内靶向药物递送机制。
此外,肿瘤组织内GSH浓度比正常组织高4倍,氧化还原电位的差异是肿瘤靶向治疗的潜在靶点。
基于还原响应的“智能型”药物载体通常含有二硫键和二硒键,高浓度的GSH可以破坏二硫键,使药物迅速释放。这些二硫键主要用作连接剂和交联剂,连接聚合物主链与药物。
基于氧化反应的载体机制是响应病理组织活性氧(reactive oxygen species,ROS)水平,ROS(一般为H?O?和-OH自由基)的水平与肿瘤、动脉硬化、心脏和神经损伤及炎症等病理状态都有关。像肿瘤等其他病理条件,ROS水平比正常组织高出1~100倍。
目前,已有多种材料用于研究氧化还原响应型载体。Yu等报道了对纳米结构、形态和组成可调的介孔有机硅纳米粒(mesoporous organosilica nanoparticles,MONs)的研究(见图2)。

图2 氧化还原响应型介孔有机硅纳米颗粒(MONs)
利用MONs中二硫键的引入,实现了纳米粒子的氧化还原响应,制备的MONs在还原性环境(10mmol·L-? GSH)中24h后被降解,7d后其大小被减小到5nm以促进肾清除。
在GSH存在下,还原性微环境触发MONs的生物降解,诱导MONs同时释放还原性抗癌药物,48h内药物释放达到75%,实现肿瘤特异性药物递送。
1.4 酶响应型
酶响应型智能药物载体,是一类特殊的生物响应性智能高分子材料。酶的表达和活性的失调,是许多疾病病理学的基础。利用这些酶在炎症或肿瘤部位的生物催化作用,可以实现酶介导的药物释放。
携带有效载荷的纳米载体,通过包封或共价键,将药物通过位点特异性酶解在靶位点释放。
大多数酶可在温和的条件下(低温、中性pH值和缓冲水溶液)催化化学反应,所以利用酶作为触发器很有优势,此外,酶也可以对底物表现出特殊的选择性,允许特定、复杂、生物诱导的化学反应。
据报道,磷脂酶、蛋白酶、氧化还原酶、糖苷酶和脂肪酶是智能药物载体中利用的典型酶,通过共价连接或物理封装,包括交联基质、自组装系统或笼状多孔结构,可将药物加载到纳米材料中。
药物载体可以被酶激活,以暴露靶向配体,以便随后内化到特定细胞中。此外,酶可以促进特定产物的产生,例如酸性环境,促进药物从载体中释放。
基于葡萄糖氧化酶(glucose oxidase,GOx)催化机制的载体是一种重要的胰岛素智能闭路载药体系,能够将葡萄糖浓度检测与胰岛素释放有机结合在一起。
GOx是一种葡萄糖专属催化酶,它通过消耗氧气将葡萄糖转化为葡萄糖酸和H?O?,同时也使得催化区域内的pH值下降,在葡萄糖水平的诊断和给药中有所应用。
顾臻团队制备了基于GOX催化机制的pH响应型、H?O?响应型、乏氧环境响应型胰岛素载体。近期,该团队根据GOx和辣根过氧化物酶(horseradish peroxidase,HRP)在异常高的葡萄糖水平下的级联酶促反应引起的3,3',5,5'-四甲基联苯胺(TMB)的显色,研制了一种成本低、便携、用于检测小鼠高血糖的经皮比色微针贴片。
1.5 其他内源性响应型
除了上述类型外,内源性刺激型药物递送系统还有响应疾病状态下特定生物分子、肿瘤细胞内高ATP浓度等。
2、外源刺激响应型
2.1 温度响应型
与内源性响应型药物载体不同,外源性温度响应型智能药物载体是接受外界环境的刺激触发,它需要外部供应热源(近红外光、超声、磁场等)来提高药物释放,并且对身体的生理温度变化不敏感。
近日,Xi等报道发现减毒沙门菌静脉注射后,可以在各种实体瘤中增殖并引起肿瘤血栓形成,通过光声成像观察到6种类型的肿瘤都会变成深色,具有强烈的近红外吸收。
在激光照射下,细菌感染的肿瘤可以被有效地消融。此外,这种基于细菌的光热疗法(photothermal therapy,PTT)由于具有免疫刺激功能,可以抵抗再发的肿瘤。
该研究表明细菌本身可以作为肿瘤特异性温度PTT试剂,使光免疫疗法能够抑制肿瘤的转移和复发,见图3。

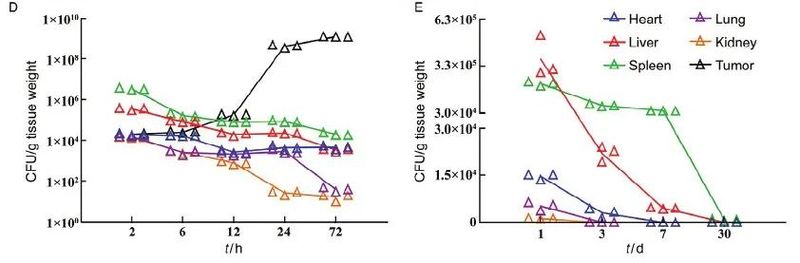
图3 基于细菌的光热疗法(PTT)示意图
2.2 光响应型
光响应型载体具有生物相容性、可生物降解、光源清洁易获得、远程操作性强、响应精准迅速等优点,为SDDSs的发展开辟了一条新的途径。
光响应型药物载体可通过光源刺激开关、改变波长、照射时间等,结构发生可逆变化,以脉冲形式释放药物。
光响应型载体主要由光敏聚合物构成,通常含有偶氮苯、螺吡喃、二芳基乙烯、三苯基甲烷、叠氮萘醌、肉桂酸酯、香豆素等感光基团。主要通过3个机制实现光触发光疗法:①光诱导疏水性亲水性转变。②光裂解反应。③PTT。
这种无创的药物递送方法响应于特定波长的光照,依赖于一次性或可重复的开关药物释放过程。
考虑到安全性和易得性,250~380nm的紫外光和700~900nm的近红外线常被用于诱导光响应。
在光触发疏水性亲水性转变机制中,Aibani等利用螺吡喃(闭环、无色、疏水)在紫外光照射下转变为部花青(开环、有色、亲水)的性质,采用简单的自组装工艺,分别制备了基于螺吡喃的光响应中空介孔二氧化硅(HMS)纳米粒子和胶束(见图4),同时通过FRET机制实现了在药物释放方面的实时监测,光触发释放与荧光读出一起实现药物释放过程的量化。

图4 基于螺吡喃-部花青光致变色二联体的物理化学变化来调控药物释放示意图
2.3 超声响应型
超声响应型药物载体应用于肿瘤诊疗,主要是基于超声的热效应和声空化效应,其中作为智能药物载体主要是基于超声的声空化效应。
超声响应型智能药物递送系统对来自外部超声波设备的微小振动进行响应,从而让药物释放,是一种广泛适用、无创、经济有效的给药方式。
超声空化效应触发药物释放是由声场中的气泡震荡和气泡塌陷实现的,通过这些微泡的内爆释放药物,同时促使肿瘤组织的脉管系统内皮细胞壁间隙扩大,对肿瘤致密的组织结构产生一定的影响,通过调谐频率、无电离辐射和暴露时间来调节组织穿透深度,从而协助药物载体在肿瘤实质组织的渗透和滞留。
超声波辅助处理的另一个优点,是增强了不可降解聚合物的渗透,加速了可降解聚合物的降解。
超声响应药物载体在肿瘤化疗领域已经进行了非常广泛的研究。Wei等设计了一种基于聚环氧乙烷-聚甲基丙烯酸二乙氨基乙酯-聚甲基丙烯酸甲氧基乙酯嵌段共聚物(PEO-b-P(DEA-stat-MEMA))的超声和pH响应性高分子材料(见图5)。
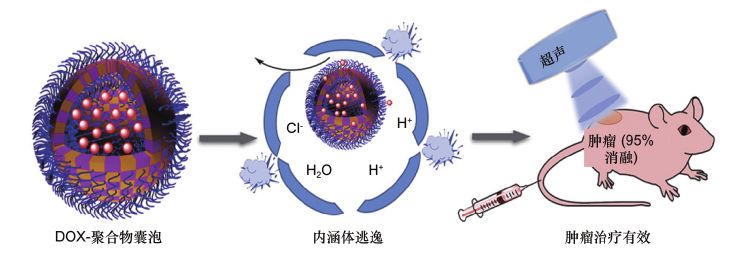
图5 可有效进行肿瘤治疗的新型超声响应性多聚体囊泡示意图
体外实验证实了多聚体具有良好的内含体逃逸能力、按需释药行为、低细胞毒性和较高的细胞内释放效率。体内抗肿瘤试验表明,在超声作用下,这些超声响应的多聚体可加速释放抗癌药物。
Baghbani等开发了多功能智能姜黄素载壳聚糖/全氟己烷纳米液滴,用于超声造影成像和按需给药。频率为1MHz、2W·cm-?的超声波作用4min,可使姜黄素从最佳处方(Cur-NDs-2)中释放63.5%,在影像引导肿瘤治疗中具有巨大的应用潜力。
2.4 磁响应型
磁响应智能药物递送,是对靶点的时间和空间控制上的又一个无创途径。磁响应载体是将磁性纳米颗粒经过表面修饰后再与药物结合形成的稳定的药物载体系统。
通常在外部施加的磁电流下,部分具有金属物质的相关磁响应载体会发生靶向、产热和形状改变。与其他刺激响应系统相比,响应时间快是它的突出优势。
磁响应型纳米药物载体的核心是磁性纳米粒子,相比于其他磁性纳米粒子,Fe?O?纳米粒子易形成超顺磁性。
由于制作简单,对正常组织和细胞毒副作用小,且能被靶向性配体分子、聚合物分子、脂质体等修饰,基于超顺磁Fe?O?的磁响应型纳米药物载体已经发展为药物递送系统中的一个重要成员。
Jiang等制备了负载氧化铁纳米颗粒的牛血清白蛋白(Fe?O?/BSA),磁性可调。颗粒可内化为骨髓间充质干细胞(mesenchymal stem cells,MSCs),在外加磁场作用下,颗粒的释放明显减慢,在恒定静磁场条件下,Fe?O?/BSA颗粒的摄取显著增强了静磁场下MSCs的成骨分化,此结果表明了磁操控干细胞分化的潜在方法。
3、多重刺激响应型
尽管上述单一刺激响应型可作为独立的控制药物释放的载体,但为了获得更好的特异性和灵活性以适应机体中众多影响因素,多重刺激响应型药物载体逐渐成为目前医药领域的研究热点,其中pH/温度、pH/氧化、温度/还原刺激组合的智能载体受到了广泛关注。
Oroojalian等合成了热响应性聚(N-异丙基丙烯酰胺)阿霉素(PNIPAM-DOX)水凝胶,并将其负载到pH响应性聚乙二醇-2,4,6-三甲氧基亚苄基季戊四醇碳酸酯(PEG-PTMBPEC)聚合物中,以制备一种智能的热/pH响应性药物传递系统(见图6)。
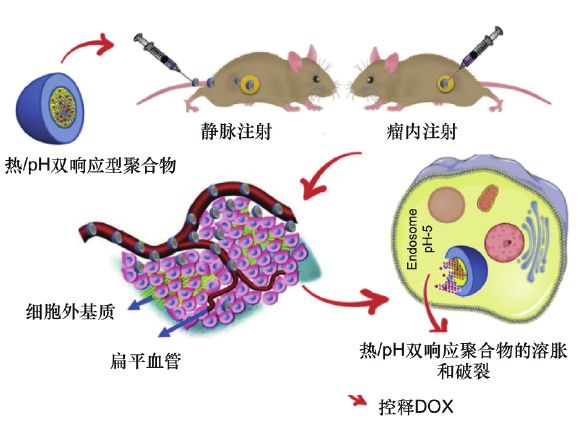
图6 由PNIPAM-DOX负载的热/pH反应性聚合体控制DOX释放示意图
体内释放评价表明,多聚体制剂的DOX释放具有pH依赖性,在37℃时,由于PNIPAM-DOX偶联物在pH响应性聚合体内部的凝胶化,药物释放速率显著降低。
与自由DOX治疗组相比,经静脉或瘤内注射的单次给药系统对小鼠肿瘤生长有明显抑制作用。
此外,用多聚体制剂治疗,在重要器官的病理改变、存活率和体重减轻方面没有引起任何系统性毒性。
晚期肿瘤相关抗原(tumor-associated antigen,TAA)表达较低的黑色素瘤患者对PD-1/PD-L1阻断治疗的响应较差。表观遗传调节剂如低甲基化的药物(hypomethylation agents,HMAs)可通过诱导TAA表达来增强抗肿瘤的免疫反应。
Ruan等将抗PD1抗体(aPD1)装入pH敏感的碳酸钙纳米颗粒(CaCO?,NPs)中,再与Zebularin(Zeb,一种HMAs)一起封装在对ROS敏感的水凝胶中,构建了一个双生物响应性水凝胶(Zeb-aPD1-NPs-gel),它可以对肿瘤微环境(the tumor microenvironment,TME)中的酸性pH和ROS做出响应,
结果表明,该联合治疗材料可以提高肿瘤细胞的免疫原性,并具有逆转免疫抑制性TME的作用,进而有效抑制B16F10-黑素瘤小鼠的肿瘤生长,延长其生存的时间。
4、结语与展望
随着药剂学、材料学和生物医学的飞速发展,各种“智能型”药物载体得到了广泛研究,“智能型”药物载体将在未来的诊疗中发挥巨大潜能。
然而,这些纳米载体缺乏标准化的制造方法、毒性评估经验以及临床前和临床研究的明确相关性。
因此,智能药物载体应在未来的研究中,应重视设计优化或寻找更小毒性、更具生物相容性的多重响应型智能载体,在动物模型和患者体内进行广泛的毒理学研究,以病理部位为靶点,尝试提出简单和直接的剂型配方,以及合理、易于转化入临床和广泛适用的策略,使药物载体真正成为临床现实的“智能”部分。
声明:铭研医药对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)







